碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.

(1)如图1分别代表了五种常见的晶体,分别是:A
NaCl
NaCl
,B
CsCl
CsCl
,C
干冰
干冰
,D
金刚石
金刚石
,E
石墨
石墨
.(填名称或化学式)
(2)干冰和冰是两种常见的分子晶体,下列关于两种晶体的比较中正确的是
ac
ac
.
a.晶体的密度:干冰>冰 b.晶体的熔点:干冰>冰
c.晶体中的空间利用率:干冰>冰 d.晶体中分子间相互作用力类型相同
(3)金刚石和石墨是碳的两种常见单质,下列叙述正确的有
ae
ae
.
a.金刚石中碳原子的杂化类型为sp
3杂化,石墨中碳原子的杂化类型为sp
2杂化;
b.晶体中共价键的键长:金刚石中C-C<石墨中C-C;
c.晶体的熔点:金刚石>石墨 d.晶体中共价键的键角:金刚石>石墨
e.金刚石晶体中只存在共价键,石墨晶体中则存在共价键、金属键和范德华力;
f.金刚石和石墨的熔点都很高,所以金刚石和石墨都是原子晶体
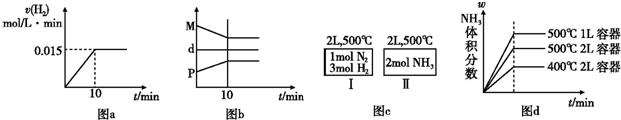
(4)金刚石晶胞结构如图2,一个晶胞中的C原子数目为
8
8
.
(5)C与孔雀石共热可以得到金属铜,铜原子的原子结构示意图为
,金属铜采用面心立方最密堆积(在晶胞的顶点和面心均含有一个Cu原子),已知Cu单质的晶体密度为ρg/cm
3,Cu的相对原子质量为M,阿伏伽德罗常数N
A,则Cu的原子半径为
.

 价电子(最外层电子)数和重原子(即比氢重的原子)数相同的分子(或离子)互称等电子体.等电子体的结构相似、物理性质相近,称为等电子原理.如N2和CO为等电子体,下表为部分元素等电子体的分类和空间构型表:
价电子(最外层电子)数和重原子(即比氢重的原子)数相同的分子(或离子)互称等电子体.等电子体的结构相似、物理性质相近,称为等电子原理.如N2和CO为等电子体,下表为部分元素等电子体的分类和空间构型表: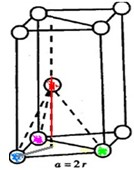 根据上述信息,回答下列问题:
根据上述信息,回答下列问题:


 碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.
碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.

 工业生产的纯碱中常含有少量的NaCl杂质.某校研究性学习活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置(说明:连接甲和乙的橡皮管有铁夹控制),先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.
工业生产的纯碱中常含有少量的NaCl杂质.某校研究性学习活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置(说明:连接甲和乙的橡皮管有铁夹控制),先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.