
题目列表(包括答案和解析)
氢是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。利用FeO/Fe3O4循环制氢,已知:
H2O(g)+3FeO(s)  Fe3O4(s)+4H2(g)
△H=akJ/mol (I)
Fe3O4(s)+4H2(g)
△H=akJ/mol (I)
2Fe3O4(s)  6FeO(s)+O2(g) △H=bkJ/mol (II)
6FeO(s)+O2(g) △H=bkJ/mol (II)
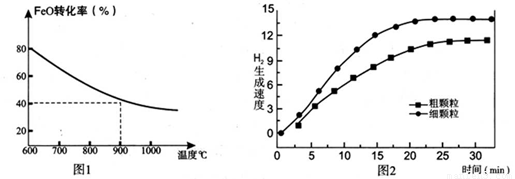
下列坐标图分别表示FeO的转化率(图-1 )和一定温度时,H2出生成速率[细颗粒(直径0.25 mm),粗颗粒(直径3 mm)](图-2)。
(1)反应:2H2O(g)=2H2(g)+O2(g) △H= (用含a、b代数式表示);
(2)上述反应b>0,要使该制氢方案有实际意义,从能源利用及成本的角度考虑,实现反 应II可采用的方案是: ;
(3)900°C时,在两个体积均为2.0L密闭容器中分别投人0.60molFeO和0.20mol H2O(g)甲容器用细颗粒FeO、乙容器用粗颗粒FeO。
①用细颗粒FeO和粗颗粒FeO时,H2生成速率不同的原因是: ;
②细颗粒FeO时H2O(g)的转化率比用粗颗粒FeO时 H2O(g)的转化率 (填“大”或“小”或“相等”);
③求此温度下该反应的平衡常数K(写出计箅过程,保留两位有效数字)。
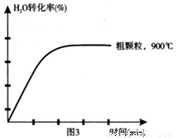
(4)在下列坐标图3中画出在1000°C、用细颗粒FeO时,H2O(g)转化率随时间变化示意图(进行相应的标注)。
|
不久前,美国一个海军航空站安装了一台 250 kW的MCFC型燃料电池,该电池可同时供应电和水蒸气,其工作温度为600~700℃,所用燃料为H2,电解质为熔融的K2CO3,已知该电池的总反应式为:2H2+O2=2H2O,负极反应式为:H2+CO32--2e- | |
| [ ] | |
A. |
该电池的正极反应式为: O2+2H2O+4e- |
B. |
该电池的正极反应式为: 2CO2+O2+4e- |
C. |
电池供应 1 mol水蒸气,转移的电子数为4 mol |
D. |
O2从正极通入,发生氧化反应 |




| 海水密度(g/mL) | CaSO4 (g/L) |
NaCl (g/L) |
MgCl2 (g/L) |
MgSO4 (g/L) |
NaBr (g/L) |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
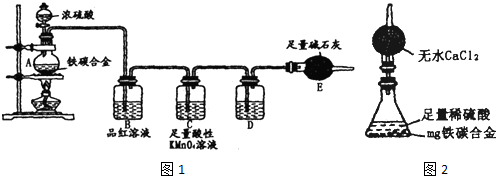
| ||
| ||
| ||
| ||
| 11m-3b |
| 11m |
| 11m-3b |
| 11m |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com