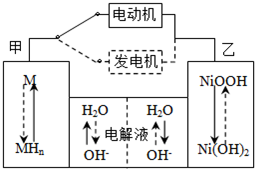
(2011?烟台模拟)第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮.汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态.
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C
8H
18计)和氧气充分反应,每生成1mol水蒸气放热569.1kJ.则该反应的热化学方程式为
C8H18(l)+25/2O2(g)═8CO2(g)+9H2O(g),△H=5121.9kJ?mol-1
C8H18(l)+25/2O2(g)═8CO2(g)+9H2O(g),△H=5121.9kJ?mol-1
.
(2)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液.镍氢电池充放电原理示意如图,其总反应式为:H
2+2NiOOH
2Ni(OH)2根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH
增大
增大
(填“增大”、“减小”或“不变”),该电极的电极反应式为
NiOOH+H2O+e-=Ni(OH)2+OH-
NiOOH+H2O+e-=Ni(OH)2+OH-
.
(3)汽车尾气的主要成分是一氧化碳和氮氧化物,治理尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g)?N
2(g)+2CO
2(g);△H<0.
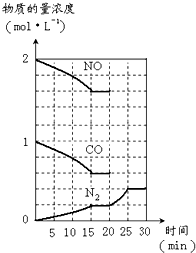
若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示.则从开始到达到平衡状态的过程中,平均反应速率v(CO
2)=
0.027mol?L-1?min-1
0.027mol?L-1?min-1
(结果保留两位有效数字).
若保持温度不变,20min时向容器中充入CO、N
2各0.6mol,平衡将
不
不
移动(填“向左”、“向右”或“不”). 20min时,若改变反应条件,导致N
2浓度发生如图所示的变化,则改变的条件可能是
b
b
(填字母).
①加入催化剂 ②降低温度
③缩小容器体积 ④增加CO
2的物质的量
A.只有①B.只有②C.只有③D.只有④



