
题目列表(包括答案和解析)
|
在一定条件下,向密闭容器中充入30 mL CO和20 mL水蒸气,使其反应,当反应CO+H2O(g) | |
A. |
平衡后CO的体积分数为40% |
B. |
平衡后CO的转化率为25% |
C. |
平衡后水的转化率为50% |
D. |
平衡后混合气体的平均相对分子质量为24 |
对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.下表是25℃时几种常见弱酸的电离平衡常数
| 酸 | 电离方程式 | 电离平衡常数K |
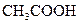 | 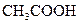  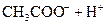 |  |
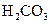 |  | 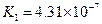 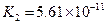 |
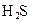 | 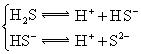 | 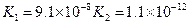 |
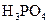 | 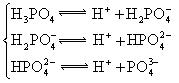 | 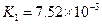 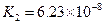 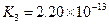 |
硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用。
(1)已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)=BaS(s)+4CO(g)? △H= + 571.2 kJ?mol—1
BaS(s)= Ba(s)+S(s)? △H= +460 kJ?mol—1
已知:2C(s)+O2(g)=2CO(g)? △H= -221 kJ?mol—1
则:Ba(s)+S(s)+2O2(g)=BaSO4(s)? △H= ? ? 。
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:
As2S3+10H++ 10NO3-=2H3AsO4+3S+10NO2↑+ 2H2O
当反应中转移电子的数目为2mol时,生成H3AsO4的物质的量为?? 。
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫各物种(H2S、HS—、S2—)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
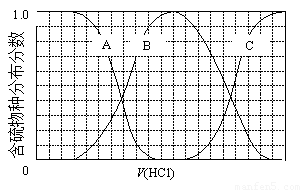
①含硫物种B表示???? 。在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为 ? (填字母)。
a.c(Na+)= c(H2S)+c(HS—)+2c(S2—)
b.2c(Na+)=c(H2S)+c(HS—)+c(S2—)
c.c(Na+)=3[c(H2S)+c(HS—)+c(S2—)]
②NaHS溶液呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是 ? (用离子方程式表示)。
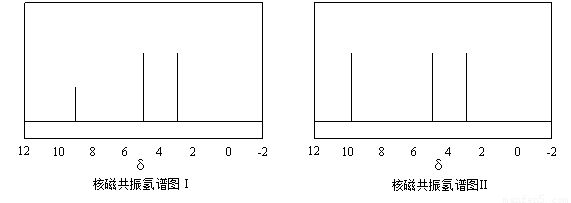
(4)硫的有机物(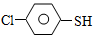 )与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。
)与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。
 及X的核磁共振氢谱如下图,其中???? (填“Ⅰ”或“Ⅱ”)为
及X的核磁共振氢谱如下图,其中???? (填“Ⅰ”或“Ⅱ”)为 的核磁共振氢谱图。写出X的结构简式:???? 。
的核磁共振氢谱图。写出X的结构简式:???? 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com