
题目列表(包括答案和解析)
(1)同主族内不同元素的E值变化的特点是:_________________。各主族中E值的这种变化特点体现了元素性质的________变化规律。
(2)同周期内,随原子序数增大,E值增大。但个别的E值出现反常现象。试预测下列关系式中正确的是________。(填写编号,多选倒扣分)
A.①E(砷)>E(硒) B.②E(砷)<E(硒)
C.③E(溴)>E(硒) D.④E(溴)<E(硒)
(3)估计1mol气态Ca原子失去最外层的1个电子所需能量E值的范围:________<E<________。
(4)10号元素E值较大的原因是________。
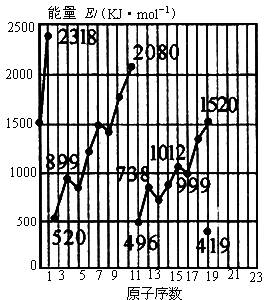
不同元素的气态原子失去最外层的1个电子所需要的能量(设其为E)如图所示。试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
(1)同主族内不同元素的E值变化的特点是:_________________。各主族中E值的这种变化特点体现了元素性质的________变化规律。
(2)同周期内,随原子序数增大,E值增大。但个别的E值出现反常现象。试预测下列关系式中正确的是________。(填写编号,多选倒扣分)
A.①E(砷)>E(硒) B.②E(砷)<E(硒)
C.③E(溴)>E(硒) D.④E(溴)<E(硒)
(3)估计1mol气态Ca原子失去最外层的1个电子所需能量E值的范围:________<E<________。
(4)10号元素E值较大的原因是________。
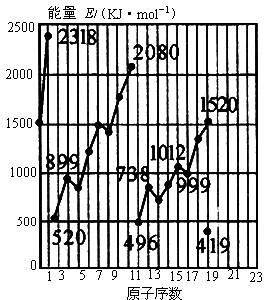
(7分)不同元素的气态原子失去最外层的1个电子所需要的能量(设其为E)如下图所示。试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
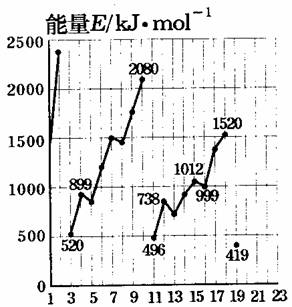
原子序数1至19号元素气态原子失去最外层的1个电子所需能量
(1)同主族内不同元素的E值变化的特点是:______________。各主族中E值的这种变化特点体现了元素性质的______________变化规律。
(2)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常现象。试预测下列关系式中正确的是______________。(填写编号,多选倒扣分)
①E(砷)>E(硒) ②E(砷)<E(硒)
③E(溴)>E(硒) ④E(溴)<E(硒)
(3)估计1mol气态Ca原子失去最外层的1个电子所需能量E值的范围:
______________<E<______________。
(4)10号元素E值较大的原因是__________________________________。
| 原子序数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| E/eV | 13.4 | 24.6 | 5.4 | 9.3 | 8.3 | 11.3 | 14.5 | 13.6 | 17.4 | 21.6 |
| 原子序数 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | |
| E/eV | 5.1 | 7.6 | 6.0 | 8.1 | 11.0 | 10.4 | 13.0 | 15.8 | 4.3 |

试根据元素在周期表中的位置,分析图中曲线的变化特点,并完成下列问题:
(1)同主族内不同元素的E值变化的特点是______________________________。各主族中E值的这种变化特点体现了元素性质的_______________变化规律。
(2)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常现象。试预测下列关系式中正确的是_______________(填写编号)。
①E(砷)>E(硒) ②E(砷)<E(硒)
③E(溴)>E(硒) ④E(溴)<E(硒)
(3)估计1 mol气态Ca原子失去最外层一个电子所需能量E值的范围:
_______________<E<_______________。
(4)10号元素E值较大的原因是_____________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com