
题目列表(包括答案和解析)
(1)(4分) 以下四组物质中都有一种与其他物质在分类上不同,试分析每组物质的组成或特点,将这种物质找出来。
A.CaO、Na2O、CO2、CuO
B. H2、Cl2、P、Cu
C.氢氧化镁、烧碱、纯碱、熟石灰
D.洁净的空气、用排空气法收集的SO2、盐酸、 冰水混合
A ;B ;C ;D 。
(2)(3分) 下列各组中两瓶无标签的无色溶液,不用其他试剂就能鉴别出来的是 ;(填序号)
(1)NaOH和AL2(SO4)3 (2)HCl和KAlO2 (3)Na2CO3和HCl
(4)NaHCO3和NaOH (5)Ca(HCO3)2和NaOH
(3)(3分)溶解 Al2O3 、Fe2O3 的混合物用去 100 mL 0.1 mol/L 的盐酸。 如果将所得溶液加入 NaOH 欲产生最大量沉淀,需用 1 mol/L 的NaOH溶液 毫升?
(1)(4分)以下四组物质中都有一种与其他物质在分类上不同,试分析每组物质的组成或特点,将这种物质找出来。
| A.CaO、Na2O、CO2、CuO |
| B. H2、Cl2、P、Cu |
| C.氢氧化镁、烧碱、纯碱、熟石灰 |
| D.洁净的空气、用排空气法收集的SO2、盐酸、冰水混合 |
(1)(4分) 以下四组物质中都有一种与其他物质在分类上不同,试分析每组物质的组成或特点,将这种物质找出来。
A.CaO、Na2O、CO2、CuO
B. H2、Cl2、P、Cu
C.氢氧化镁、烧碱、纯碱、熟石灰
D. 洁净的空气、用排空气法收集的SO2、盐酸、 冰水混合
A ;B ;C ;D 。
(2)(3分) 下列各组中两瓶无标签的无色溶液,不用其他试剂就能鉴别出来的是 ;(填序号)
(1)NaOH和AL2(SO4)3 (2)HCl和KAlO2 (3)Na2CO3和HCl
(4)NaHCO3和NaOH (5)Ca(HCO3)2和NaOH
(3)(3分)溶解 Al2O3 、Fe2O3 的混合物用去 100 mL 0.1 mol/L 的盐酸。 如果将所得溶液加入 NaOH 欲产生最大量沉淀,需用 1 mol/L 的NaOH溶液 毫升?
| A.CaO、Na2O、CO2、CuO |
| B. H2、Cl2、P、Cu |
| C.氢氧化镁、烧碱、纯碱、熟石灰 |
| D.洁净的空气、用排空气法收集的SO2、盐酸、冰水混合 |
(已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。
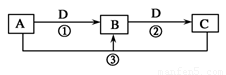
请回答下列问题:
若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质
①加热蒸干B的溶液不能得到B,则B的化学式可能是________________;工业上制取A的离子方程式为__________________________________。
②用A制备漂白粉的化学方程式是________________________________________________。反应②的离子方程式是______________________________________________________,配制C的溶液时可加入少量的______(填物质名称)以抑制水解。
(2)若A是某强酸的稀溶液,则A的化学式可能是________。
(3)若D是氯碱工业的主要产品之一,B有两性,则反应②的离子方程式是________________________。
(4)若A、B、C的的焰色反应都呈黄色,D是气态酸性氧化物,则D可能是______或______(填化学式),鉴别这两种气态酸性氧化物常可选用________________(填一种试剂名称)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com