
题目列表(包括答案和解析)
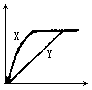
将足量的锌粒分别加入到pH=1,体积均为20mL的醋酸(X)和盐酸(Y)的溶液中,下列各图能正确表示这个实验结果的是
(纵坐标表示产生![]() 的质量,横坐标表示反应的时间)
的质量,横坐标表示反应的时间)
[ ]




 CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1
CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1 CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1
CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1
| 16 |
| 3 |
| 16 |
| 3 |
 CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011 |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
 ①温度升高,K值
①温度升高,K值工业上高纯硅可以通过下列反应制取:
SiCl4(g)+2H2(g)完成下列填空:
1.在一定温度下进行上述反应,若反应容器的容积为2 L,H2的平均反应速率为0.1 mol/(L·min),3 min后达到平衡,此时获得固体的质量________g.
2.该反应的平衡常数表达式K=________.可以通过________使K增大.
3.一定条件下,在密闭恒容容器中,能表示上述反应一定达到化学平衡状态的是________.
a.2v逆(SiCl4)=v正(H2)
b.断开4 mol Si-Cl键的同时,生成4 mol H-Cl键
c.混合气体密度保持不变
d.c(SiCl4)∶c(H2)∶c(HCl)=1∶2∶4
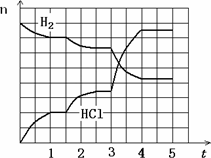
4.若反应过程如下图所示,纵坐标表示氢气、氯化氢的物质的量(mol),横坐标表示时间(min),若整个反应过程没有加入或提取各物质,则第1.5分钟改变的条件是________,第3分钟改变的条件是________,各平衡态中氢气转化率最小的时间段是________.
工业上高纯硅可以通过下列反应制取:SiCl4(g)+
2H2(g)  Si
(s) + 4HCl(g) -236kJ
Si
(s) + 4HCl(g) -236kJ
完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为2L,H2的平均反应速率为0.1mol/(L·min),3min后达到平衡,此时获得固体的质量 g。
(2)该反应的平衡常数表达式K= 。可以通过_______使K增大。
(3)一定条件下,在密闭恒容容器中,能表示上述反应一定达到化学平衡状态的是 。
a.2v逆(SiCl4)=v正(H2)
b.断开4molSi-Cl键的同时,生成4molH-Cl键
c.混合气体密度保持不变
d.c(SiCl4):c(H2):c(HCl)=1:2:4
(4)若反应过程如图所示,纵坐标表示氢气、氯化氢的物质的量(mol),横坐标表示时间(min),若整个反应过程没有加入或提取各物质,则第1.5分钟改变的条件是______,第3分钟改变的条件是__________,各平衡态中氢气转化率最小的时间段是_____________ 。
工业上高纯硅可以通过下列反应制取:SiCl4(g)+ 2H2(g)  Si (s)+ 4HCl(g) -236kJ
Si (s)+ 4HCl(g) -236kJ
完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为2L,H2的平均反应速率为0.1mol/(L·min),3min后达到平衡,此时获得固体的质量 g。
(2)该反应的平衡常数表达式K= 。可以通过_______使K增大。
(3)一定条件下,在密闭恒容容器中,能表示上述反应一定达到化学平衡状态的是 。
a.2v逆(SiCl4)=v正(H2)
b.断开4molSi-Cl键的同时,生成4molH-Cl键
c.混合气体密度保持不变
d.c(SiCl4):c(H2):c(HCl)=1:2:4
(4)若反应过程如图所示,纵坐标表示氢气、氯化氢的物质的量(mol),横坐标表示时间(min),若整个反应过程没有加入或提取各物质,则第1.5分钟改变的条件是______,第3分钟改变的条件是__________,各平衡态中氢气转化率最小的时间段是_____________ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com