
题目列表(包括答案和解析)
 简称:EPABA)是白色粉末,味苦而麻,易溶于乙醇,不溶于水.是局部麻醉药,用于手术后创伤止痛,溃疡痛等.苯佐卡因的合成路线如下:(Na2Cr2O7是一种强氧化剂)
简称:EPABA)是白色粉末,味苦而麻,易溶于乙醇,不溶于水.是局部麻醉药,用于手术后创伤止痛,溃疡痛等.苯佐卡因的合成路线如下:(Na2Cr2O7是一种强氧化剂)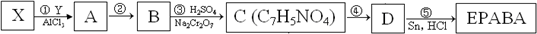
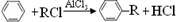 ;
;
 .
.





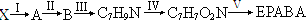 ,却始终没有成功,请分析可能原因:
,却始终没有成功,请分析可能原因: 镁、铝、铁及其化合物在生产和生活中有广泛的应用.
镁、铝、铁及其化合物在生产和生活中有广泛的应用.| 实验序号 | I | II | III |
| 加入钢样粉末的质量(g) | 2.812 | 5.624 | 8.436 |
| 生成气体的体积(L)(标准状况) | 1.120 | 2.240 | 2.800 |
| 0.12 |
| 28.12 |
| 0.12 |
| 28.12 |

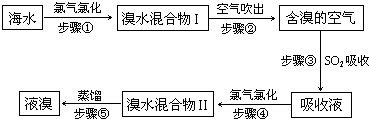
| 实验 编号 |
KClO3 (g) |
氧化物 | 产生气体(mL) (已折算为标况) |
耗时(s) | ||
| 化学式 | 质量(g) | 回收 | ||||
| 1 | 0.6 | - | - | - | 10 | 480 |
| 2 | 0.6 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| 3 | 0.6 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| 4 | 0.6 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| 5 | 0.6 | Cr2O3 | 0.20 | 异常 | 67.2 | 188.3 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com