
题目列表(包括答案和解析)
 对于可逆反应,mA(g)+nB(g)?pC(g)+qD(g);H<0有下列判断,其中正确的是( )
对于可逆反应,mA(g)+nB(g)?pC(g)+qD(g);H<0有下列判断,其中正确的是( )


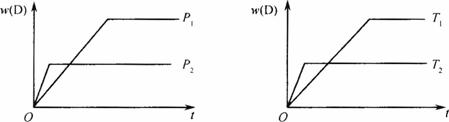
图1-1
A.降温化学平衡向正反应方向移动
B.使用合适的催化剂可使w(D)有所增加
C.化学方程式中化学计量数m<p+q
D.B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com