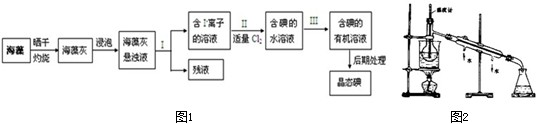
碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的以碘离子形式存在的碘元素.海带中含有丰富的碘.为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是
BDE
BDE
(从下列仪器中选出所需的仪器,用标号字母填写在空白处).
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是
过滤
过滤
;步骤⑤实验操作名称是
萃取分液
萃取分液
.
(3)步骤④也可以用Cl
2来起相同作用,写出Cl
2参加反应的离子方程式
2I一+Cl2=I2+2Cl一
2I一+Cl2=I2+2Cl一
.
(4)步骤⑤中,除选择用苯来提取碘,还可选择的试剂是
C
C
.
A.酒精 B.醋酸 C.四氯化碳 D.甘油
(5)为使从含碘有机溶液中提取碘并回收溶剂顺利进行,采用水浴加热蒸馏(如图所示).请指出图中实验装置中两处错误
①
①缺石棉网
①缺石棉网
,
②
②温度计插到液体中 ③冷凝管进出水方向颠倒(写2个即可)
②温度计插到液体中 ③冷凝管进出水方向颠倒(写2个即可)
.
(6)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:
取少量提取碘后的水溶液于试管中,加入几滴淀粉试液;观察是否出现蓝色(如果变蓝,说明还有单质碘)
取少量提取碘后的水溶液于试管中,加入几滴淀粉试液;观察是否出现蓝色(如果变蓝,说明还有单质碘)
.


 已知:MnO2+4HCl(浓)
已知:MnO2+4HCl(浓) 碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的以碘离子形式存在的碘元素.海带中含有丰富的碘.为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的以碘离子形式存在的碘元素.海带中含有丰富的碘.为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
 如图所示,甲、乙两池电极材料都是铁棒和石墨棒,请回答下列问题:
如图所示,甲、乙两池电极材料都是铁棒和石墨棒,请回答下列问题: