
题目列表(包括答案和解析)
A、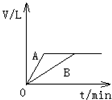 | B、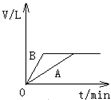 | C、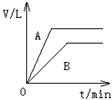 | D、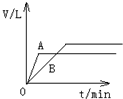 |
称取三份锌粉,分别盛于甲、乙、丙三支试管中 。甲加入50mLpH=3的盐酸,乙加入50mLpH=3的醋酸,丙加入50mLpH=3的醋酸及少量的胆矾粉末。若反应终了,生成氢气的体积一样多,且没有剩余的锌,则下列说法错误的是
A.开始时反应速率的大小:甲=乙=丙
B.反应过程中,甲、乙速率相同
C.反应终了时,所需时间的大小:甲>乙>丙
D.三支试管中参加反应的锌的质量:甲=乙<丙
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com