
题目列表(包括答案和解析)
 某化学兴趣小组欲研究一种镁铝合金,以下是部分实验.请完成填空.
某化学兴趣小组欲研究一种镁铝合金,以下是部分实验.请完成填空.| 方法 | 需测定的数据 |
| ① | 测定产生的H2的体积 |
| ② |
(10分) 某化学兴趣小组欲研究一种镁铝合金,以下是部分实验。请完成填空。
[实验一]从镁铝合金片上剪下一小块,先称重,然后投到盛有10mL 10mol·L—1NaOH溶液(足量)的锥形瓶里。
(1)从反应开始至反应结束,依次可观察到的现象有:①切口断面处先产生气泡,反应由慢到快;②小块合金在溶液中上下翻腾;③溶液升温;④反应后,溶液中残留黑色固体。
(2)开始时产生气泡速率慢,其主要原因(除温度、电化学因素外)是 。
(3)欲利用此反应测定合金中铝的含量,请仿照方法①写出另一种不同方法所需数据。
|
方法 |
需测定的数据 |
|
① |
测定产生的H2的体积 |
|
② |
|
[实验二]向实验一的锥形瓶里滴加1 mol·L—1HCl,使镁、铝两种元素恰好只以氯化物的形式存在。
[实验三]请设计合理实验检验实验二所得溶液中的Mg2+、Al3+。
限选实验用品与试剂:烧杯、试管、滴管、1 mol·L-1NaOH溶液、1 mol·L-1HCl溶液、蒸馏水。
根据你设计的实验方案,叙述实验操作、预期现象和结论。(可填满、可不填满)
|
实验操作 |
预期现象和结论 |
|
步骤1: |
|
|
步骤2: |
|
|
…… |
|
[实验四]粉末状试样A是由MgO和Fe2O3组成的混合物。取适量A进行铝热反应,产物中有单质B生成。产物中的单质B是 (填化学式)。
(10分) 某化学兴趣小组欲研究一种镁铝合金,以下是部分实验。请完成填空。
[实验一]从镁铝合金片上剪下一小块,先称重,然后投到盛有10mL 10mol·L—1NaOH溶液(足量)的锥形瓶里。
(1)从反应开始至反应结束,依次可观察到的现象有:①切口断面处先产生气泡,反应由慢到快;②小块合金在溶液中上下翻腾;③溶液升温;④反应后,溶液中残留黑色固体。
(2)开始时产生气泡速率慢,其主要原因(除温度、电化学因素外)是 。
(3)欲利用此反应测定合金中铝的含量,请仿照方法①写出另一种不同方法所需数据。
| 方法 | 需测定的数据 |
| ① | 测定产生的H2的体积 |
| ② |
|
[实验二]向实验一的锥形瓶里滴加1 mol·L—1HCl,使镁、铝两种元素恰好只以氯化物的形式存在。
[实验三]请设计合理实验检验实验二所得溶液中的Mg2+、Al3+。
限选实验用品与试剂:烧杯、试管、滴管、1 mol·L-1NaOH溶液、1 mol·L-1HCl溶液、蒸馏水。
根据你设计的实验方案,叙述实验操作、预期现象和结论。(可填满、可不填满)
| 实验操作 | 预期现象和结论 |
| 步骤1: |
|
| 步骤2: |
|
| …… |
|
[实验四]粉末状试样A是由MgO和Fe2O3组成的混合物。取适量A进行铝热反应,产物中有单质B生成。产物中的单质B是 (填化学式)。
[实验一]从镁铝合金片上剪下一小块,先称重,然后投到盛有10mL 10mol·L-1NaOH溶液(足量)的锥形瓶里。
(1)从反应开始至反应结束,依次可观察到的现象有:①切口断面处先产生气泡,反应由慢到快;②小块合金在溶液中上下翻腾;③溶液升温;④反应后,溶液中残留黑色固体。
(2)开始时产生气泡速率慢,其主要原因(除温度、电化学因素外)是___________。
(3)欲利用此反应测定合金中铝的含量,请仿照方法①写出另一种不同方法所需数据。
方法 | 需测定的数据 |
① | 测定产生的H2的体积 |
② |
|
[实验二]向实验一的锥形瓶里滴加1 mol·L-1HCl,使镁、铝两种元素恰好只以氯化物的形式存在。写出此过程中含铝元素的化合物所发生的离子反应方程式:___________________。
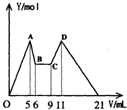
[实验三]取实验二的锥形瓶里的溶液10mL,向其中滴加amL c1 mol·L-1NaOH之后,改成滴加c2mol·L-1 HCl,所得沉淀Y(mol)与试剂总体积V(mL)间的关系如图所示。据此,回答下列问题:

(1)图中CD段消耗盐酸的体积是AB段消耗的NaOH溶液体积的两倍,则c1/c2=__________;
(2)所加入NaOH溶液的体积a=________mL。
(10分)某化学兴趣小组欲研究一种镁铝合金,以下是部分实验。请完成填空。
[实验一]从镁铝合金片上剪下一小块,先称重,然后投到盛有10mL 10mol·L—1NaOH溶液(足量)的锥形瓶里。
(1)从反应开始至反应结束,依次可观察到的现象有:①切口断面处先产生气泡,反应由慢到快;②小块合金在溶液中上下翻腾;③溶液升温;④反应后,溶液中残留黑色固体。
(2)开始时产生气泡速率慢,其主要原因(除温度、电化学因素外)是 。
(3)欲利用此反应测定合金中铝的含量,请仿照方法①写出另一种不同方法所需数据。
| 方法 | 需测定的数据 |
| ① | 测定产生的H2的体积 |
| ② | |
| 实验操作 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| …… | |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com