
题目列表(包括答案和解析)
 =2Cr(OH)3↓+3O2↑+2H2O
=2Cr(OH)3↓+3O2↑+2H2O =2Cr(OH)3↓+3O2↑+2H2O
=2Cr(OH)3↓+3O2↑+2H2O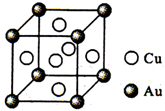 催化剂中毒是微量杂质和催化剂活性中心的某种化学成分作用,形成没有活性的物质.CO会使合成氨的催化剂(还原铁)中毒,CO易与Fe发生反应Fe+5CO═Fe(CO)5.除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3═Cu(NH3)3(CO)Ac.
催化剂中毒是微量杂质和催化剂活性中心的某种化学成分作用,形成没有活性的物质.CO会使合成氨的催化剂(还原铁)中毒,CO易与Fe发生反应Fe+5CO═Fe(CO)5.除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3═Cu(NH3)3(CO)Ac. (2011?崇明县一模)在500mL 某浓度的硝酸溶液中加入20g铁粉,充分反应后,将反应液过滤、洗涤、干燥,称得固体质量为3.2g,产生的NO2和NO气体经测定为8.96L(标准状况).
(2011?崇明县一模)在500mL 某浓度的硝酸溶液中加入20g铁粉,充分反应后,将反应液过滤、洗涤、干燥,称得固体质量为3.2g,产生的NO2和NO气体经测定为8.96L(标准状况).| 40n |
| 3 |
| 40n |
| 3 |
(9分)(1)在容积为3L的密闭容器中,由I2(g)和H2(g)合成HI(g),在其他条件不变的情况下,研究温度对反应的影响,HI的物质的量的变化情况如下图所示。
①温度为T1时,在0~tAmin内,H2的消耗速率
v (H2)=________________
②分析右图所示图像,下列说法正确的是_________(填序号)

a.温度为T2,容器内气体密度不变时,反应到达B点所示状态
b.平衡状态从A点移动到B点,n(HI)/n(H2)增大
c.该反应为放热反应
(2) 加水稀释0.1mol·L-1的HF溶液,下列各量中增大的是________(填序号)
a.c(H+) b. Ka(HF) c. c(F-)/c(H+) d. c(H+) / c(HF)
(3) 在0.1mol·L-1HCl溶液中加入过量AgNO3溶液,产生白色沉淀,再滴加KI溶液,出现黄色沉淀,试写出有关的离子方程式 、 。
(9分)(1)在容积为3L的密闭容器中,由I2(g)和H2(g)合成HI(g),在其他条件不变的情况下,研究温度对反应的影响,HI的物质的量的变化情况如下图所示。
①温度为T1时,在0~tAmin内,H2的消耗速率
v (H2)=________________
②分析右图所示图像,下列说法正确的是_________(填序号)
a.温度为T2,容器内气体密度不变时,反应到达B点所示状态
b.平衡状态从A点移动到B点,n(HI)/n(H2)增大
c.该反应为放热反应
(2) 加水稀释0.1mol·L-1的HF溶液,下列各量中增大的是________(填序号)
a.c(H+) b. Ka(HF) c. c(F-)/c(H+) d. c(H+) / c(HF)
(3) 在0.1mol·L-1HCl溶液中加入过量AgNO3溶液,产生白色沉淀,再滴加KI溶液,出现黄色沉淀,试写出有关的离子方程式 、 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com