
题目列表(包括答案和解析)
(1)常温下,将20.0 g 14%的NaCl溶液跟30.0 g 24%的NaCl溶液混合,得到密度为1.17 g/cm3的混合溶液,该混合溶液中NaCl的物质的量浓度为 mol/L。
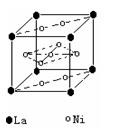
(2)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。右图为该合金的晶体结构中最小的重复结构单元,其中心有一个镍原子,其他镍原子都在面上,镧原子都在顶点上。该晶体的化学式为 。
(3)含氮废水进入水体而对环境造成的污染越来越严重,环境专家认为可以用金属镁将水体中的NO![]() 还原为N2,从而消除污染。
还原为N2,从而消除污染。
①写出镁和含氮废水反应的离子方程式 ;
②上述反应中,生成标准状况下33.6L氮气时,转移电子的物质的量为 mol。③已知金属镁可以从海水中提取的MgCI2通过电解制得的,若要除去含氮元素0.3mol的废水中的NO![]() ,则至少需要含0.5%(质量分数)MgCl2的海水 kg。
,则至少需要含0.5%(质量分数)MgCl2的海水 kg。
| |||||
(1)常温下,将20.0 g 14%的NaCl溶液跟30.0 g 24%的NaCl溶液混合,得到密度为1.17 g/cm3的混合溶液,该混合溶液中NaCl的物质的量浓度为 mol/L。
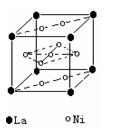
(2)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。右图为该合金的晶体结构中最小的重复结构单元,其中心有一个镍原子,其他镍原子都在面上,镧原子都在顶点上。该晶体的化学式为 。
(3)含氮废水进入水体而对环境造成的污染越来越严重,环境专家认为可以用金属镁将水体中的NO![]() 还原为N2,从而消除污染。
还原为N2,从而消除污染。
①写出镁和含氮废水反应的离子方程式 ;
②上述反应中,生成标准状况下33.6L氮气时,转移电子的物质的量为 mol。③已知金属镁可以从海水中提取的MgCI2通过电解制得的,若要除去含氮元素0.3mol的废水中的NO![]() ,则至少需要含0.5%(质量分数)MgCl2的海水 kg。
,则至少需要含0.5%(质量分数)MgCl2的海水 kg。
常温下,将20.0 g 14.0%的NaCl溶液跟30.0 g 24.0%的NaCl溶液混合,得到密度为1.15 g·ml-1的混合溶液,计算该混合溶液的质量分数为________,物质的量浓度为________mol·L-1.在100 g水中需溶入________mol NaCl,才能使其浓度与上述混合溶液的浓度相等.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com