
题目列表(包括答案和解析)
肼(N2H4)又称联氨,是一种可燃性液体,可用作火箭燃料。
(1)肼的结构式为______________。
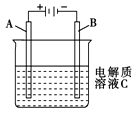
(2)如图是一个电化学过程示意图。
①铂片上发生的电极反应是______________。
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化为128g,则肼-空气燃烧电池理论上消耗标准状况下的空气_____L(假设空气中氧气体积百分含量为20%)。
(3)肼-空气燃料电池是一种碱性燃料电池,生成无污染的物质。电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时负极的电极反应式是_______________________________________。
肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均可生成氮气和水.氢气是一种清洁能源,液氢和肼均可用作火箭燃料.
Ⅰ氢气的制取与储存是氢能源利用领域的研究热点.
已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH=+247.4 kJ·mol-1
(1)氢气作为新能源的优点________.(答2点)
(2)以甲烷为原料制取氢气是工业上常用的制氢方法.CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________.
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图所示.图中A、B表示的物质依次是________、________.

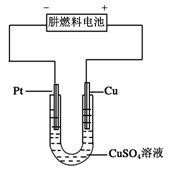
Ⅱ(4)肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液.该电池放电时,负极的电极反应式是________.
(5)下图是一个电化学装置示意图.用肼一空气燃料电池做此装置的电源.

①如果A是铂电极,B是石墨电极,C是硫酸-硫酸铵,阴极的电极反应式是________.
②利用该装置可制得少量过氧化氢:在阳极上SO42-被氧化成S2O82-(过二硫酸根离子),S2O82-与H2O反应生成H2O2,S2O82-+2H2O=2SO42-+H2O2+2H+.若要制取2 molH2O2,该燃料电池理论上需消耗________molN2H4.
(6)由A、B、C、D四种金属按下表中装置进行实验.
实验装置与现象

根据实验现象回答下列问题:
①装置丙中溶液的PH________.(填“变大”“变小”或“不变”)
②四种金属活泼性由弱到强的顺序是________.
肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均可生成氮气和水,可用作火箭燃料.
(1)写出肼与一氧化氮反应的化学方程式________.
(2)肼——空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.该电池放电时,负极的电极反应式是________________________.
(3)下图是一个电化学装置示意图.用肼——空气燃料电池做此装置的电源.
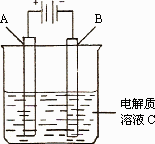
①如果A为含有铁、银、金、碳等杂质的粗铜,B为纯铜,C为CuSO4.通电一段时间后,溶液中Cu2+的浓度将________(填“增大”、“减小”或“不变”).
②如果A是铂电极,B是石墨电极,C是硫酸,阴极的电极反应式是________.利用该装置可制得少量过氧化氢:在阳极上![]() 被氧化成
被氧化成![]() (过二硫酸根离子).
(过二硫酸根离子).![]() 与H2O反应生成H2O2,
与H2O反应生成H2O2,![]()
![]() .若要制取1 mol H2O2,该燃料电池理论上需消耗________mol N2H4.
.若要制取1 mol H2O2,该燃料电池理论上需消耗________mol N2H4.
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:N2(g)+2O2(g)=2NO2(g)? ΔH=+67.7kJ/mol, 2N2H4(g)+2NO2(g)=3N2(g) +4H2O(g) ΔH=-1135.7kJ/mol,下列说法正确的是
A.N2H4(g)+O2(g)=N2(g)+2H2O(g)? ΔH=-1068 kJ/mol
B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O=N2H5+ + OH-
C.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,放电时的负极反应式:N2H4-4e-+4OH-=N2↑+4H2O
D.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,工作一段时间后,KOH溶液的pH将增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com