
题目列表(包括答案和解析)
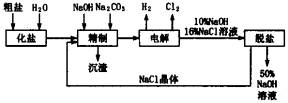
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上发生反应的化学方程式为____________,与电源负极相连的电极附近,溶液Ph________(选填“不变”“升高”或“下降”)。
(2)工业食盐含Ca2+、Mg2+、SO42-等杂质。精制过程发生反应的离子方程式为________。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去________,该钡试剂可以是________。
(选填“a”“b”或“c”,多选扣分)
A. Ba(OH)2 B. Ba(NO3)2 C. BaCl2
(4)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为____________。
(选填“a”“b”或“c”,多选扣分)
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却、_______
除去NaCl。(填写操作名称)
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应,采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为________

| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
铁元素及其化合物与人类的生产生活息息相关,回答下列问题
(1)铁酸钠(Na2FeO4)是一种新型水处理剂,它有比高锰酸钾更强的氧化性,在水中反应被还原为Fe3+.
①铁酸钠中铁元素的化合价为________.
②铁酸钠用于水处理,除了能消毒杀菌外,还可以像明矾(KAl(SO4)2)一样起到净水作用,请说明明矾的净水原理:________.(用离子方程式表示)
(2)反应ⅠFe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
反应ⅡCO(g)+1/2O2(g)=CO2(g) ΔH=b kJ·mol-1
测得在不同温度下,K值如下:
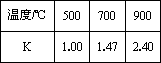
①写出K的表达式________.
②反应Ⅰ中的a________0(填大于、小于、等于).
③若500℃时进行反应Ⅰ,CO2起始浓度为2 0mol·L-1,CO的平衡浓度为________mol·L-1.
④700℃反应Ⅰ达到平衡,要使得该平衡向右移动,其它条件不变时,可以采取的措施有________(填序号).
A.缩小反应器体积
B.通入CO2
C.升高温度到900℃
D.使用合适的催化剂
⑤由反应Ⅰ和Ⅱ可求得,反应2Fe(s)+O2(g)=2FeO(s)的ΔH=________kJ·mol-1.
(3)铁红是一种红色颜料,其成份是Fe2O3.将一定量的铁红溶于160 mL 5 mol·L-1盐酸中,再加入一定量铁粉恰好完全溶解,收集到气体2.24 L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为________g.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com