
题目列表(包括答案和解析)
解释下列现象。发生化学反应的,用化学方程式进行解释。
(1) 湿衣服晾干。
(2)用石灰浆粉刷过的墙壁。刚开始会“冒汗”。
(3)将生锈的铁钉放人稀盐酸中,过一会取出,铁钉光亮如新。(铁锈的主要成分Fe203)
下列装置常用于实验室制取气体。根据给出的装置回答下列问题:
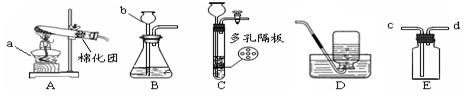
⑴指出编号仪器名称:a ;b 。
⑵用高锰酸钾固体制氧气,反应的化学方程式为 ;
选用的发生装置是 (填“A”、“B”或“C”)。
⑶实验室制取二氧化碳时,如用E装置收集CO2,则气体应从 端通入(填“c”或“d”),验满的方法是 ,相对于B装置,C装置的优点是 。
⑷将纯净的二氧化碳气体通入盛有蒸馏水的洗气瓶一段时间后,测得该装置中溶液的PH
7(填“>”、“<”或“=”),用化学方程式解释该现象为

| A.向油锅泼水 | B.赶快跑开 |
| C.用扇子向油锅扇风 | D.用锅盖盖紧油锅 |



 表示氯原子
表示氯原子  表示钠原子
表示钠原子  表示氧原子
表示氧原子| 实验装置 | 实验现象 | 实验结论 |
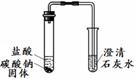 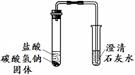 实验Ⅰ 实验Ⅱ | 实验I、II中均观察到:白色固体逐渐减少, ;澄清石灰水变浑浊。 | Na2CO3和NaHCO3都能与盐酸反应产生CO2;NaHCO3与盐酸反应的化学方程式是 。 |
| | t1/℃ | t2/℃ | t3/℃ |
| Na2CO3 | 23.3 | 20.0 | 23.7 |
| NaHCO3 | 18.5 | 20.0 | 20.8 |
某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;二是发生双水解反应:2Fe3++3 SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3。为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ:取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是 。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是 。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为
。另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是 。
实验Ⅱ:换用稀释的FeCl3和Na2SO3溶液重复实验Ⅰ。实验Ⅰ、Ⅱ产生的现象完全相同。由上述实验得出的结论是 。若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是 。从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
① ;
② .
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com