
题目列表(包括答案和解析)
| ||
. |
废铜屑与浓硫酸反应,能制得硫酸铜,其反应原理是:
Cu+2H2SO4(浓)===CuSO4+X↑+2H2O,则X是_________(写化学式)。
(2005
年山西)废铜屑与浓硫酸反应,能制得硫酸铜,其反应原理是: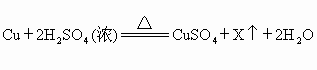
 ,则X是(写化学式).若用废铜屑、稀硫酸和空气作原料制取硫酸铜,依次写出制备过程中发生反应的化学方程式,.
,则X是(写化学式).若用废铜屑、稀硫酸和空气作原料制取硫酸铜,依次写出制备过程中发生反应的化学方程式,.(18分)硫酸亚铁铵晶体俗名为摩尔盐,化学式为xFeSO4·y(NH4)2SO4·zH2O,在制药、电镀方面有广泛的应用。
资料: ①硫酸亚铁铵晶体易溶于水,不溶于乙醇;
②相关物质的溶解度(单位:g)如下表:
| 温度/℃ | FeSO4 | (NH4) 2SO4 | xFeSO4·y(NH4)2SO4·zH2O |
| 10 | 20.0 | 73 | 17.2 |
| 20 | 26.5 | 75.4 | 21. 6 |
| 30 | 32.9 | 78 | 28.1 |



湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com