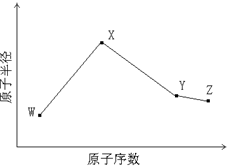
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH
4+具有相同的质子、电子数目; W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强.
(1)Y在周期表中的位置是
.
(2)用电子式解释X与W能形成化合物X
3W的原因
.
(3)X
3W遇水可释放出使酚酞溶液变红的气体A,化学方程式是
.
(4)用惰性电极电解化合物XZ溶液从阴极释放出气体B,反应的离子方程式是
.
(5)已知W的单质与气体B在一定条件下可形成气体A,即:W
2(g)+3B (g)?2A(g)△H=-92.4kJ?mol
-1在某温度时,一个容积固定的密闭容器中,发生上述反应.在不同时间测定的容器内各物质的浓度如下表:
| 时间 |
浓度(mol/L) |
| c(W2) |
c(B) |
c(A) |
| 第0min |
4.0 |
9.0 |
0 |
| 第10min |
3.8 |
8.4 |
0.4 |
| 第20min |
3.4 |
7.2 |
1.2 |
| 第30min |
3.4 |
7.2 |
1.2 |
| 第40min |
3.6 |
7.8 |
0.8 |
①W
2的平均反应速率v(0min~10min)/v(10min~20min)=
;
②反应在第10min改变了反应条件,改变的条件可能是
;
a.更新了催化剂 b.升高温度 c.增大压强 d.增加B的浓度
③若反应从第30min末又发生了一次条件改变,改变的反应条件可能是
;
a.更新了催化剂 b.升高温度 c.增大压强 d.减小A的浓度.

 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目; W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目; W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强. (2011?安徽)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
(2011?安徽)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大. W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.(以下答案的W、X、Y、Z必须用相应的元素符号代替)
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.(以下答案的W、X、Y、Z必须用相应的元素符号代替)

 (2013?济宁一模)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )
(2013?济宁一模)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( ) W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z是
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z是
