
题目列表(包括答案和解析)
2.保护水资源:禁用含磷洗衣粉;生活污水、工业污水处理达标后再排放;
农业上合理使用农药、化肥等。
保护空气:禁止在农田里焚烧秸杆;汽车加装尾气净化装置;不能随意焚烧垃圾;
鼓励使用无污染绿色能源,如太阳能等。
本题为开放题,符合主题、切合实际的答案均可得分。
3答案:在盛NaOH溶液的烧杯中滴入几滴无色醛酞试液,溶液变红色。在NaOH溶液中加入过量的稀盐酸(红色褪去为止),溶液变无色,表明溶液中已无NaOH,由此证明两者确实发生了化学反应。
注:此题属于探究性试题,答案是开放性的,只要方法合理均给分。加入的物质只要能证明两者反应的,就给2分,方法合理给2分。能答出超过一种方法的,每种奖励2分,本题最多奖励4分,本卷最高分不超过60分。
4答案:(共9,每空1分,填表除外)
① H2O;CO2 ; ②Na2CO3 ; ③
|
步骤和方法(2分) |
现象(2分) |
分析(2分) |
|
①取少量固体于试管中,滴入盐酸; ②把生成的气体通入澄清石灰水。 |
有气泡产生, 石灰水变浑浊。 |
碳酸钠与盐酸反应放出CO2; CO2能使石灰水变浑浊。 结论:该白色固体是Na2CO3 |
5答案:⑴铁丝在氧气中燃烧 生成黑色固体
⑵石灰石与稀盐酸反应 石灰石表面有气泡冒出
⑶镁带在氧气中燃烧 生成白色固体等,其他合理也给分
6答案:⑴葡萄糖是由碳、氢、氧三种元素组成的。
⑵葡萄糖中C、H、O三种元素的原子个数比为1∶2∶1
(其它答案合理的可同样得分)
7答案:(1)不正确 如果盐酸滴加过量,滴入酚酞试液也不变色
(2)(以下方法任写一种均可得分)
|
①取样,滴加紫色石蕊试液 |
试液变红 |
盐酸过量 |
|
②取样,滴加紫色石蕊试液 |
试液不变红 |
恰好中和 |
|
③取样,滴加碳酸钠溶液 |
有气泡产生 |
盐酸过量 |
|
④取样,滴加碳酸钠溶液 |
无气泡产生 |
恰好中和 |
|
⑤取样,加入锌粒等活泼金属 |
有气泡产生 |
盐酸过量 |
|
⑥取样,加入锌粒等活泼金属 |
无气泡产生 |
恰好中和 |
8答案:(1) 方法一 锌 取少量样品分别与锌粒反应,有气体产生的原样品是稀盐酸,
没有气体产生的是氯化钠溶液。
方法二 氧化铜 取少量样品分别与氧化铜粉末反应,氧化铜溶解并能得蓝色溶液的原样品是盐酸,氧化铜不溶解的是氯化钠溶液。
(或 碳酸钠 取少量样品分别与碳酸钠反应,有气体产生的原样品是盐酸没有明显现象的是氯化钠溶液。
氢氧化铜 取少量样品分别与氢氧化铜反应,氢氧化铜溶解并能得蓝色溶液的原样品是盐酸,氢氧化铜不溶解的是氯化钠溶液等。)
(2)用玻璃棒分别蘸取少量溶液在酒精灯上加热,玻璃棒上有固体留下的是氯化钠溶
液,没有的是盐酸。(或用玻璃棒分别蘸取少量溶液在酒精灯上加热,有刺激性气味体产生的是盐酸,无气味的是氯化钠溶液。)
9答案:(1)3 NaCl (2)不正确;盐酸过量,酚酞也不变色
(3)(以下方法任写一种均可得分)
|
①取样,滴加紫色石蕊试液 |
试液变红 |
盐酸过量 |
|
②取样,滴加紫色石蕊试液 |
试液不变红 |
恰好中和 |
|
③取样,滴加碳酸钠溶液 |
有气泡产生 |
盐酸过量 |
|
④取样,滴加碳酸钠溶液 |
无气泡产生 |
恰好中和 |
|
⑤取样,加入锌粒等活泼金属 |
有气泡产生 |
盐酸过量 |
|
⑥取样,加入锌粒等活泼金属 |
无气泡产生 |
恰好中和 |
10答案:[收集证据]
|
猜想 |
可行的实验方案 |
|
猜想② |
将一小块切开的苹果放入盛有氧气的集气瓶中,观察现象 |
|
猜想③ |
将一小块切开的苹果放入盛有氮气的集气瓶中,观察现象 |
|
猜想④ |
将一小块切开的苹果放入盛有二氧化碳的集气瓶中,观察现象 |
|
猜想⑤ |
各取一小块苹果分别放入两支集满氧气的试管中,将其中一支试管放入热水中,观察两试管中苹果的变色速度 |
[得出结论]是果肉中的成分与氧气作用的结果,“生锈”的速度与温度有关,温度越高,果肉变色速度越快。
[反思与评价](1)③ 氮气的化学性质很稳定,通常不与其他物质反应。(2)水中溶解了氧气
[应用]将水果在隔绝空气的条件下加工,采用真空包装并低温保存。
11答案:(1)一氧化氮和一氧化碳(2)这是一个开发性的问题,可能的答法有如下几类:
A.限制汽车的数量,如限制私人汽车的数量,大力发展公共交通
B. 将汽车全部加装三效转换器等汽车环保设备,使汽车尾气得到净化。
C. 改用清洁环保型燃料,如酒精、液化气等
D.使用电力汽车
(3)这是一个开放性的问题,可能的答法有如下几种
A. 关于氢气的来源问题,如:如何获得大量而廉价的氢气?
B. 关于氢气的保存和运输问题,如:如何贮存和运输大量的氢气?
C. 关于氢气在汽车上的使用问题,如:汽车上如何安装一定量的氢气?
D. 关于氢气使用的安全性问题,如:如何防止氢气在使用、贮存和运输过程中的安全。
12答案:
|
方法 |
实验步骤 |
现象和结论 |
|
① |
用试管取少量失去标签的溶液, 用滴管滴入几滴紫色石蕊试液 |
如果溶液变红色说明是酸 |
|
② |
用试管取少量失去标签的溶液,往试管中滴加少量碳酸钠溶液 |
有气泡产生说明是酸 |
|
③ |
往试管中加入锌粒, 然后往试管中倒入少量失去标签的溶液 |
有气泡产生说明是酸 |
|
④ |
…… |
…… |
13答案: (1)①物理性质:臭氧是淡蓝色气体 ②化学性质:臭氧有强氧化性 ③用途:应用于游泳池、生活用水、污水的杀菌和消毒。
(2)答案很多(略)
14答案:
(1) 3CO +
3Fe2O3  2Fe + 3CO2(2分,没配平或没有条件共扣1分)
2Fe + 3CO2(2分,没配平或没有条件共扣1分)
(2)(共6分)
|
实验步骤 |
实验现象、结论 |
|
1、向瓶中倒入适量澄清石灰水,振荡。(1分) |
集气瓶内的石灰水变混浊(1分),说明气体中含有二氧化碳。(1分) |
|
2、往步骤1中的剩余气体里伸入燃着的木条。(1分) |
集气瓶内出现蓝色火焰(放出热量)或气体燃烧(1分),说明气体中含有一氧化碳。(1分) |
15答案:
|
方案 |
所选药品 |
有关化学方程式 |
|
1 |
铁钉、铜片、稀硫酸 |
Fe+H2SO4
== FeSO4+H2↑
|
|
2 |
铁钉、硫酸铜溶液 |
Fe+CuSO4 == FeSO4+Cu |
16答案:(1) ①淡蓝色气体
②具有强氧化性 ③ 用于游泳池、生活用水、污水的杀菌和消毒 ;
(2) 构成它们各自分子的氧原子的个数不同
(3) 3O2  2O3
;
2O3
;
(4) 6P + 5O3 =点燃 3P2O5
(5) CO2 可用于灭火但过多排放会造成温室效应(符合题意的均给分)
1.C
38.(雅安中学初2009级“一诊”测试)
(4分)某镇有座硫酸厂,设备简陋,技术陈旧,该厂每天排放大量含二氧化硫的废气和含硫酸的酸性废水。当地的其他工厂和居民均用煤炭作燃料。只要下雨就下酸雨,对该镇环境造成极大破坏。
(1)分析该镇下酸雨的原因: ,
(2)举一例说明酸雨对环境造成的危害: ,
(3)该镇某中学环保小组提出了治理酸雨的下列措施,你认为其中不妥的是 ,
A.将硫酸厂搬离该镇 B.建议环保部门限令整改
C.将硫酸厂的废气中的二氧化硫处理后排放 D.工厂和居民改用较清洁的燃料
(4)可用熟石灰来处理硫酸厂排出的酸性废水,处理原理的化学方程式是
。
专题二 开放性试题
37.(雅安中学初2009级“一诊”测试)(2分)化学兴趣小组利用课余时间自制氧气,有同学从家里拿来了洗脸盆并盛了半盆自来水,用罐头瓶(带玻璃片)装满水倒放入脸盆中准备收集气体,还有同学从化工试剂商店买来了高锰酸钾作原料。由于自带仪器不够用,又有同学准备从学校化学实验室借用一些仪器。问:
①还需借用的仪器有_____________________________________________;
②检验收集的气体是O2的方法是__________________________________。
36.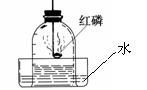 (安丘市2009年中考模拟化学试题)右图所示装置可用来测定空气中氧气的含量。对该实验认识不正确的是
(安丘市2009年中考模拟化学试题)右图所示装置可用来测定空气中氧气的含量。对该实验认识不正确的是
A.红磷的量不足会影响实验结论
B.装置不漏气是实验成功的重要因素之一
C.将红磷改为碳也能得到正确的实验结论
|
35.(安丘市2009年中考模拟化学试题)(7分)实验室有一标签残缺的盐酸,请你来探究。
(1)若确定它不是浓盐酸的方法是 。
(2)粗略测定每毫升盐酸中含溶质HCl的质量。同学们依据酸和碱中和反应的原理,设计了一种可行的实验方案,其操作步骤如下:
第一步:在小烧杯中加入8g5%的氢氧化钠溶液;滴入2滴酚酞试液;
第二步:向10mL的量筒里注入该盐酸至一定刻度,记下读数V1;
第三步:用胶头滴管吸取量筒中的盐酸,逐滴滴入上述烧杯中,直至到溶液由红色刚刚变为无色为止;
第四步:记录并整理数据;
第五步:计算,确定每毫升盐酸中含溶质HCl的质量。
请根据以上实验过程,回答下面问题:
① 写出盐酸和氢氧化钠发生中和反应的化学方程式 。
② 本实验要用指示剂的目的是 。
③ 第三步的操作缺少两个重要环节,请你补充完整。
、 。
④ 如量筒中剩余盐酸的体积为V2 mL,则每毫升盐酸中含溶质HCl的质量是
g。
(3)测定每毫升盐酸中含溶质HCl的质量的方法还有许多,请你写出一种其他可行的方法。(要求:与上述方法的原理不同、简述所依据的原理和要测定的数据。)
34、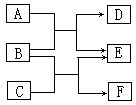 ( 江苏省通州市通西片九年级化学第一次模拟考试试卷)物质A-F都是初中化学中的常见物质,它们有如图所示的转化关系。回答下列问题:
( 江苏省通州市通西片九年级化学第一次模拟考试试卷)物质A-F都是初中化学中的常见物质,它们有如图所示的转化关系。回答下列问题:
(1)若A为固体非金属单质, E为红色固体单质,则B、D的化学式为:B 、D 写出下列反应化学方程式:A+B: 。
(2)若E为一种盐,则A、C的化学式可能是 、 ;写出下列反应化学方程式:B+C: 。
33、( 江苏省通州市通西片九年级化学第一次模拟考试试卷)甲、乙两组同学在探究物质的性质实验时,得到的废液中共含有K+、Ba2+、Cu2+、OH-、NO3-、CO32-六种离子。经测试:甲组同学实验所得废液的pH =13;那么,乙组同学实验废液中含有的离子是 。
经合作讨论,甲、乙两组同学将实验产生的废液按适当比例混合后,可将废液中对环境污染较为严重的Ba2+、Cu2+、OH-离子除去。请写出废液混合后发生的任意两个反应的化学方程式:
① ;② 。
32、(江苏省扬州市江都地区学校2009年月考化学试卷)松花蛋又名皮蛋,微山湖出产的松花蛋因色味具佳享誉齐鲁。松花蛋的制作工艺一般是用水将灰料[主要是生石灰(CaO)、纯碱(Na2CO3)、食盐(NaCl)等]调成糊状,涂于新鲜鸭蛋,密封保存一段时间后,即可得到松花蛋。请根据以上信息回答:
①松花蛋腌制中共发生 个化学反应,写出其中属于化合反应的化学反应化学方程式: 。
②剥除松花蛋外边灰料后,常常发现蛋壳上有一些坚硬的不溶于水的白色斑点,这斑点的主要成分是 ,写出这种成分与盐酸反应的化学方程式:___________________ _________。
③食用劣质松花蛋时往往有涩味,食用时如何除去涩味_____________。
31、(江苏省扬州市江都地区学校2009年月考化学试卷)化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。
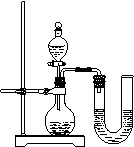 该组同学将不同浓度的盐酸和NaOH溶液各10 mL混合,用
该组同学将不同浓度的盐酸和NaOH溶液各10 mL混合,用
温度计测定室温下混合前后温度的变化,并记录了每次混合
前后温度的升高值△t(如下表)。
|
编号 |
盐酸 |
NaOH溶液 |
△t/℃ |
|
1 |
3.65﹪ |
2.00﹪ |
3.5 |
|
2 |
3.65﹪ |
4.00﹪ |
x |
|
3 |
7.30﹪ |
8.00﹪ |
14 |
(1)表中x = 。
(2)某同学在没使用温度计的情况下,通过右图所示装置完成了实验。则该同学根据
判断NaOH溶液与稀盐酸发生了中和反应。
⑶关于实验中的细节和意外情况:
①实验中,稀盐酸必须用胶头滴管逐滴滴加,这样做的目的是 。
②实验过程中,要用玻璃棒不断搅拌,这样做的目的是 。
③在实验过程中意外发现有气泡出现,你认为原因是 。
④发现盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末。他们依据所学的化学知识,对这种白色粉末的成分作了如下猜想:① 可能是NaOH;你认为:② 可能是__________; ③ 可能是_________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com