
题目列表(包括答案和解析)
4.置换反应:
(1)定义:由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应
(2)表达形式:单质1 + 化合物1 ==== 单质2 + 化合物2
A + BC ==== B + AC
3. 常见溶液的颜色:CuSO4溶液:蓝色 FeSO4 、FeCl2溶液:浅绿色
常见溶液的颜色:CuSO4溶液:蓝色 FeSO4 、FeCl2溶液:浅绿色
(5)金属的活动顺序:
人们通过大量的实验验证得到常见金属的活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
 金属活动性:由强到弱
金属活动性:由强到弱
注意:
1)在金属活动性顺序里,金属的位置越靠前,它的活动性越强。
2)在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢。
3)在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来(K、Ca、Na除外)。
3. 金属的化学性质:
金属的化学性质:
(1)金属与氧气反应:大多数金属都可以与氧气反应,但是反应需要的条件不同
A:镁与氧气反应:
1)常温下:2Mg+O2 =2MgO

2)点燃时:4Al+3O2 ====2Al2O3
现象:剧烈燃烧,放出大量的热和耀眼的白光,生成白色固体。
C:铁与氧气反应:
1) 常温下:干燥的条件不反应,但是在潮湿的环境下反应:铁与空气中的氧气和水共同作用下会生成暗红色疏松的物质--铁锈(Fe2O3·H2O)
|
2) 点燃时:3Fe+2O2 ======Fe3O4
现象:剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体。
D:铜与氧气反应:
1) 常温条件下:干燥的环境不进行反应,但是在潮湿的条件下:
2Cu+O2+CO2+H2O=Cu2(OH)2CO3
现象:铜表面生成一层绿色物质
|
2) 加热时:2Cu+O2 =====2CuO
现象:铜丝表面逐渐变为黑色
E:Au、Ag即使在高温的情况下也不与氧气反应
(2)金属与酸反应:
金属 + 酸 → 盐 + H2↑ 置换反应(条件:活动性:金属>H )

 H2SO4 + Mg
MgSO4 + H2↑ 2HCl
+ Mg
MgCl2+ H2↑
H2SO4 + Mg
MgSO4 + H2↑ 2HCl
+ Mg
MgCl2+ H2↑
现象:反应剧烈,有大量气泡产生,液体仍为无色

 3H2SO4
+ 2Al
Al2(SO4)3 + 3H2↑ 6HCl +
2Al
2AlCl3+ 3H2↑
3H2SO4
+ 2Al
Al2(SO4)3 + 3H2↑ 6HCl +
2Al
2AlCl3+ 3H2↑
现象:反应剧烈,有大量气泡产生,液体仍为无色

 H2SO4
+Zn
ZnSO4 + H2↑
2HCl +Zn ZnCl2
+ H2↑
H2SO4
+Zn
ZnSO4 + H2↑
2HCl +Zn ZnCl2
+ H2↑
现象:反应比较剧烈,有大量气泡产生,液体仍为无色

 H2SO4 + Fe FeSO4 + H2↑
2HCl + Fe FeCl2+
H2↑
H2SO4 + Fe FeSO4 + H2↑
2HCl + Fe FeCl2+
H2↑
现象:反应比较缓慢,有气泡产生,液体由无色变为浅绿色
铜与酸不反应
注:通过以上的实验现象可以得出结论:Mg、Zn、Fe的金属活动性比铜强,它们能置换出稀硫酸或稀盐酸中的氢。
(3) 金属与盐反应:金属 + 盐 → 另一金属 + 另一盐
置换反应(条件:参加反应的金属活泼性>化合物中金属元素的)
A:铁丝浸入硫酸铜溶液中:
Fe+CuSO4= Cu+FeSO4
现象:浸入溶液的铁钉表面覆盖一层紫红色的物质,溶液由蓝色逐渐变为浅绿色
B:铝丝浸入硫酸铜溶液中:
Cu+2AgNO3=Cu(NO3)2+2Ag
现象:浸入溶液的铜丝表面覆盖一层银白色的物质,溶液由无色逐渐变为蓝色
C:铜丝浸入硝酸银溶液中
Cu+2AgNO3=Cu(NO3)2+2Ag
2. 合金:
1. 几种重要的金属:
(1) 常见金属的共同性质:

B:一般金属呈现银白色,但是铜呈现紫红色,金呈现黄色
(2) 物质的用途是是由哪些因素决定的:
A:很大程度上是由物质的性质决定的。
B:还需考虑到物质的价格,资源,是否美观,使用是否便利以及废料是否易于回收和对环境的影响。
5.将20g CaCl2和CaC03 的固体混合物放入到 65.9g 水中充分溶解, 并加入 21.2%5Og 的Na2CO3溶液, 恰好完全反应。
(1) 写出与 Na2C03 溶液发生的化学反应方程式 ;
(2) 求原固体混合物中 CaCl2 的质量 ;
(3) 求生成溶液的质量 ;
(4) 若将生成的溶液蒸发, 得到t℃的饱和溶液 , 此时的溶解度为 36g/100g 水 , 求需蒸发掉多少克水 ?
4.把4g硫粉在给定质量的氧气中燃烧,有关实验数据如下表所示:
|
|
第一次 |
第二次 |
第三次 |
|
O2质量(g) |
3 |
4 |
6 |
|
SO2质量(g) |
6 |
|
|
请回答下列问题:
(1)第1次实验中,参加反应的S的质量、O2的质量与生成的SO2的质量比是 。
(2)请你通过计算求出第2次实验生成二氧化硫多少克?
(3)在表中填写第3次实验生成二氧化硫的质量。
3.加热氯酸钾和二氧化锰的混合物15克,使其完全反应。在一定温度下,向残留固体中加入4克水,有9.24克固体未溶解,再加入2克水,仍有8.28克固体未溶解,且剩余固体为混合物。
求:(1)生成氧气的质量。
(2)此温度下,氯化钾的溶解度。
(3)原混合物中氯酸钾的质量。(精确到0.1)
2.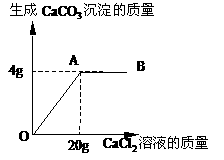 碳酸钠和氯化钠的混合物14g,常温溶解在足量水中,向溶液中逐滴加入氯化钙溶液。加入氯化钙溶液的质量与生成的CaCO3沉淀的质量的关系如图
碳酸钠和氯化钠的混合物14g,常温溶解在足量水中,向溶液中逐滴加入氯化钙溶液。加入氯化钙溶液的质量与生成的CaCO3沉淀的质量的关系如图
(1)图象中表示恰好完全反应的点是 ;
(2)求原混合物中氯化钠的质量分数。(精确到0.01%)
1.含有不溶性杂质的粗盐12.0克,放入适量水中,氯化钠全部溶解。过滤后,恰好得到20℃时的NaCl的饱和溶液44.2克。往上述氯化钠饱和溶液中加入足量的硝酸银溶液,充分反应后生成白色沉淀。将沉淀过滤、烘干、冷却后称量,所得质量为28.7克。求:
(1)粗盐中氯化钠的百分含量; (2)20℃时NaCl的溶解度。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com