
题目列表(包括答案和解析)
4.分离下列混合物时,按溶解、过滤、蒸发的操作顺序进行的是( )
A.混有泥沙的粗盐 B.混有少量NaCl的KNO3
C.混有少量CaCO3的BaSO4 D.实验室用KClO3与MnO2混合加热后的剩余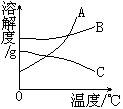 物
物
3.下列有关溶液的叙述错误的是( )
A.溶液各部分的性质都相同
B.固体、液体、气体都可作溶质
C.温度一定时,析出晶体后的溶液一定是不饱和溶液
D.t℃时,36g食盐溶解在100g水中恰好饱和,t℃时食盐的溶解度为36g
2.下列因素与固体物质的溶解度无关的是( )
A.溶剂的质量 B.溶质的质量
C.溶剂的种类 D.温度
1.有某温度时某物质的饱和溶液,在温度不变的条件下蒸发一部分溶剂后,有晶体析出,则该溶液( )
A.仍为饱和溶液 B.溶液中溶质的质量分数变小
C.溶解度变小 D.变成不饱和溶液
(二)固体的溶解度
1.概念中的四要素:①一定温度 ②100克溶剂 ③饱和状态 ④质量
2.固体溶解度与溶解性的关系:
溶解度是衡量物质溶解性大小的尺度,是溶解性的定量表示方法
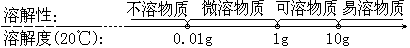
3.影响固体溶解度的因素
内因:溶质和溶剂的性质

4.溶解度曲线


5.溶解度与溶质的质量分数的关系
|
项目 |
溶解度(S)
|
溶质的质量分数(a%) |
|
概念 |
在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量 |
溶质质量与溶液质量之比 |
|
意义 |
物质溶解性的定量表示方法 饱和溶液里:溶质质量与溶剂质量关系 |
溶液浓、稀程度的表示方法
溶质质量与溶液质量的关系(与溶液饱和与否无关) |
|
条件 |
一定温度、100g溶剂、饱和状态
|
与温度无关、溶剂量无限制,溶液不一定要饱和 |
|
单位 |
克(g)
|
是比值,单位为1 |
|
计算公式 |
 ×100g(饱和溶液) ×100g(饱和溶液) |
 ×100% ×100%
|
|
联系 |
一定温度下,饱和溶液:a%=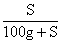 ×100% ×100% |
[典型例题讲解]
例1.下列说法中不正确的是( )
①溶液都是无色透明、均一、稳定的混合物。②同种溶质的饱和溶液一定比它的不饱和溶液浓。③糖水是溶液,盐水是溶液,混合在一起,既有糖又有盐,就不是溶液了。④在某种溶质的饱和溶液中再加入这种溶质,溶液的质量随之增大。⑤一杯调好的糖水,喝第一口特别甜,越喝越不甜,说明后来喝的糖水要变稀些。⑥把饱和溶液温度升高时,若溶液质量不变,则溶液质量也不变。
A.②④⑤⑥ B.①③④⑤ C.①②③④⑤ D.①②③⑤⑥
[解析]此题是有关溶液、饱和溶液概念的判断。溶液不一定无色,故①错。溶液的饱和与否与温度有关,②没有指明温度也不正确。溶液中的溶质可以是一种也可以是多种,故③不对。饱和溶液在同条件下不再溶解同种溶质,故④不正确。溶液是均一的,这只是味觉的迟钝造成的错误,故⑤也不正确。⑥正确,所以答案为:C。
例2.欲将某温度下接近饱和的硝酸钾溶液变成饱和溶液,不能采取的措施是( )
A.加入硝酸钾晶体 B.蒸发一定量水
C.给溶液加热 D.给溶液降温
[解析]本题关键在于充分理解饱和溶液与不饱和溶液的转化条件。因为硝酸钾的溶解度随温度升高而增大。因此降低溶液温度可达到目的。另外,向溶液中加入硝酸钾晶体或蒸发溶剂亦可达到目的。这三种措施单独使用或同时使用都可以。
答案:C。
例3.下图为A、B两种物质的溶解度曲线。回答下列问题:
(1)图中P点的含义是____。
(2)t℃时,A物质的溶解度___B物质的溶解度(填“大于”、“小于”或“等于”)
(3)B物质属于____溶物质(填“易”、“可”、“微”或“难”)
(4)当B中含有少量A时,可用____法提纯B。
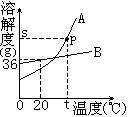
[解析]本题主要考查溶解度曲线表示意义,溶解度与溶解性关系以及结晶法的原理。
答案为:(1)t℃时A物质的溶解度是sg (2)大于
(3)易 (4)蒸发溶剂
例4.某溶液中含有四种离子Na+、Mg2+、Cl-、SO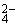 ,其中:Na+、Mg2+、Cl-离子个数比为4:7:6,若Na+离子个数为4a,则SO
,其中:Na+、Mg2+、Cl-离子个数比为4:7:6,若Na+离子个数为4a,则SO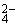 离子个数为____。
离子个数为____。
[解析]解决此类问题的关键是充分理解溶液中电荷守恒原理:所有阳离子带的正电荷总数等于所有阴离子带的负电荷总数。依题意可知:溶液中Mg2+、Cl-的个数分别为7a、6a个。设此时溶液SO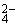 离子数为x,则4a×1+7a×2=6a×1+2x,x=6a。故本题答案为:6a。
离子数为x,则4a×1+7a×2=6a×1+2x,x=6a。故本题答案为:6a。
[综合测试]
(一)饱和溶液、不饱和溶液、浓溶液、稀溶液
1.饱和溶液与不饱和溶液的相互转化

2.四个概念间的关系:
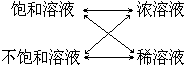
饱和溶液、不饱和溶液与浓溶液和稀溶液之间没有必然的联系,它们是从两个不同的角度对溶液进行的分类。
[基础知识的归纳与整理]

[关键知识点拨]
教学重点:溶液的组成特征、饱和溶液与不饱和溶液、溶质的质量分数。
教学难点:饱和溶液与不饱和溶液关系、溶解度与溶质的质量分数关系。
2.加深对溶液、饱和溶液、不饱和溶液、溶解度以及溶质的质量分数等基本概念的理解和掌握。
能力目标:提高学生分析、综合、分类、对比、抽象、概括能力。
情感目标:培养学生内外因辩证关系、对立统一规律等辩证唯物主义观点。体验理论是为实践服务的。
知识目标:
1.通过复习,使学生形成知识体系。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com