
题目列表(包括答案和解析)
1. 生活中的下列物质属于纯净物的是
(A)食用醋
(B)酱油
(C)干冰
(D)矿泉水
31.(7分) 含有少量铜粉的氢氧化镁粉末(均匀混合),其中镁元素的质量分数为40%。取该混合物粉末30 g与一定量的20%的硫酸恰好完全反应,求反应后所得溶液的溶质质量分数?(计算结果保留两位小数)
30.(3分) 把10g铁和铜的混合物放到盛有足量盐酸的烧杯中,充分反应后,烧杯中物质的总质量比反应前(铁、铜混合物和盐酸)减少了0.2g,求混合物中铜的质量分数。
29.(5分)化学小组的同学为验证蜡烛(主要成分是石蜡)的燃烧产物,并测定蜡烛中碳、氢两种元素的质量比,设计的实验装置如下(注:反应前全套装置中残留的空气及反应后A瓶内残留的燃烧产物均忽略不计,且各装置均能吸收完全)。
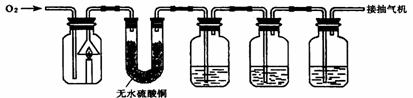
A B C D E
(1)实验步骤有:①称量②再称量③点燃蜡烛,并通入氧气(控制氧气流量)④停止通氧气,使蜡烛熄灭⑤按图示连接仪器⑥将装置冷却至室温。则实验步骤的顺序是(填数字序号) _______________。
(2)可供选择的试剂有:稀硫酸、浓硫酸、盐酸、澄清石灰水、氢氧化钠浓溶液等。则装置C、D中所盛放的试剂依次为______ _________;装置E的作用是______________________________。
(3)为测定蜡烛中碳、氢两种元素的质量比,反应前、后必须称量装置(填装置序号) _______________的质量。
28.(7分) 在实验台上摆放着如下仪器和药品:
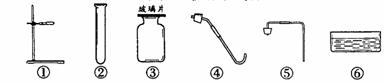
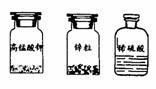
(1)根据提供的仪器和药品可以制取的气体是 ,发生反应的化学方程式为 。
(2)利用以上仪器和药品制取该气体应选择的仪器为 。
(3)将纯净的该气体通入盛有氧化铜的试管中一段时间后加热,观察到的现象是:
,在用此气体还原氧化铜的实验中,进行如下实验:①加热 ②停止加热 ③通入此气体 ④停止通此气体。请按正确操作顺序排列序号 。
(4)利用提供的药品还可以制得初中学习过的另一种气体,但缺少的仪器是 ,
检验此种气体的方法是 。
27.(3分) 某电镀厂排放的废水中含有超量有毒重金属盐Ba(NO3)2、Cu(NO3)2、AgNO3,该厂想用氢氧化钾溶液、盐酸、硫酸三种试剂,将所排废水中的重金属离子逐一变成沉淀回收,最后得到只含一种化肥的中性溶液。假设每种试剂只用一次,每步操作恰好完全反应。请你按照所加试剂的顺序,写出生成三种沉淀的化学方程式:
第一步:
第二步:
第三步:
26.(2分) 要将100g98%的硫酸稀释成19.6%的硫酸,需加水 克,稀释浓硫酸的正确操作是 。
25.(3分) 有A、B、C三种物质,已知A为钠盐,B为氯化物,C为碱。经下列实验操作,其结果分别是:①A、B的溶液混合后无沉淀或气体产生;
②B、C的溶液混合后出现蓝色沉淀;
③A、C的溶液混合后出现白色沉淀,该沉淀不溶于稀硝酸。
则A为 ,B为 ,C为 (填写化学式)
24.(10分) 我市濒江临海,有较长的海岸线,海洋资源十分丰富。
(1)海水晒盐可获得粗盐,在实验室中粗盐经过溶解、 、 可制得精盐。
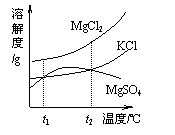 (2)晒盐后得到的卤水中含有MgCl2、KCl和MgSO4等物质,右图是它们的溶解度曲线示意图。
(2)晒盐后得到的卤水中含有MgCl2、KCl和MgSO4等物质,右图是它们的溶解度曲线示意图。
①设t1℃时MgCl2、KCl和MgSO4三种物质的溶解度分别为a、b、c,则它们的大小关系为 。
②将卤水加热到t2℃以上,根据溶解度曲线,首先析出的晶体是 。
(3)目前世界上60%的镁是从海水中提取的。其主要步骤如下:
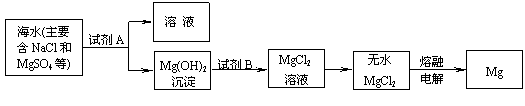
①提取Mg的过程中,试剂A可以选用_________,试剂B选用_________。
②分离出Mg(OH)2后的NaCl溶液中还含有CaCl2、Na2SO4等杂质,为了获得NaCl溶液,在分离后的溶液中依次加入过量的BaCl2溶液、Na2CO3溶液,过滤,再向滤液中加入适量盐酸。实验中加入过量BaCl2溶液是为了除去 ;加入过量Na2CO3溶液的目的是 。
(4)目前海水淡化普遍采用“多级闪急蒸馏法”,证明蒸馏得到的水为淡水的方法是
。海底矿产资源“可燃冰”,其主要成分是水合甲烷晶体(CH4·nH2O),若水合甲烷晶体中CH4的质量分数为10%,则水合甲烷晶体的化学式为 。
19.(3分)下图是某分子变化前后的示意图。图中“●” 表示氢原子,“○”表示氧原子。
  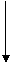 单质A 单质A
|
 |
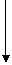 化合物甲 化合物甲 |
+化合物丙 +单质B
|
化合物甲+化合物乙 |
|
化合物丁 |
据此写出相关物质的化学式:单质B ,化合物丙 ;化合物丁 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com