
题目列表(包括答案和解析)
4、pH的测定方法
用玻璃棒蘸(或用胶头滴管吸取)被子测溶液在pH试纸上,把试纸的颜色与标准比色卡对照,得出溶液的pH(通常取整数)
用pH试纸测定溶液的pH时要注意:
(1)不能直接将pH试纸浸入待测溶液中,以免带入杂质,污染试剂。
(2)不能将pH试纸润湿,否则,等测溶液被稀释,测量不准确。
(3)用pH试纸检验酸性或碱性气体时,可将pH试纸润湿再用。
[例1](2009·乐山)结合下表中所列物质的pH判断,在下列各组物质中,分别能使紫色石蕊溶液变红、不变色、变蓝的是( )
|
物质 |
酱油 |
厕所清洁剂 |
血浆 |
牙膏 |
肥皂水 |
橘汁 |
草木灰水 |
柠檬汁 |
|
pH |
4.8 |
1.7 |
7.4 |
8.2 |
9.2 |
3.5 |
10.6 |
2.5 |
A.柠檬汁、食盐水、厕所清洁剂 B.牙膏、蒸馏水、肥皂水
C.草木灰、蒸馏水、柠檬汁 D.橘汁、食盐水、草木灰水
[答案]D
[解析]使紫色石蕊溶液变红的是酸性溶液,不变色的是中性溶液,变蓝的是碱性溶液。厕所清洁剂的pH为1.7,显酸性,使紫色石蕊试液变红色,所以A错误,牙膏的pH为8.2,显碱性,使紫色石蕊试液变蓝,所以B错误,草木灰和柠檬汁的pH分别为10.6和2.5,分别使紫色石蕊试液变蓝和变红,所以D不正确。
[规律小结]pH=7,溶液呈中性,遇到无色酚酞试液和紫色石蕊试液均不变色;pH<7,溶液呈酸性,可以使紫色石蕊试液变红色,遇无色酚酞试液不变色;pH>7,溶液呈碱性,可以是紫色石蕊试液变蓝色,使无色酚酞试液变红色。
变式训练一
3、pH与溶液酸、碱性的关系
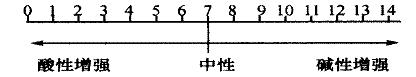

pH=7,溶液呈中性
pH<7,溶液呈酸性
pH>7,溶液呈碱性
注意:(1)pH越小,酸性越强。当酸溶液被稀释时,溶液pH变大,但不会变成碱性,所以稀释后溶液的pH不会大于7。反之,pH越大,碱性越强。当碱溶液稀释时,溶液pH变小,但不会变成酸性,所以稀释后溶液的pH不会小于7。
(2)并不是所有的盐溶液pH都等于7。如NaCl、K2SO4
等溶液,pH=7,而Na2CO3溶液pH>7。
2、溶液的酸碱性和酸碱度
(1)溶液的酸碱性是指溶液是酸性还是碱性;溶液酸碱度是指溶液酸碱性强弱的程度。常用酸碱指示剂检验溶液的酸碱性。粗略测定溶液的酸碱度常用pH试纸。
(2)酸溶液(碱溶液)与酸性溶液(碱性溶液)是两组不同的概念。酸溶液是指酸的水溶液,酸性溶液是指呈酸性(pH<7)的溶液。酸溶液一定呈酸性,但酸性溶液不一定是酸溶液(NaHSO4溶液)。碱溶液与碱性溶液也存在上述关系(如Na2CO3溶液)。
(3)溶液的酸碱性与溶液的电中性是不同的概念。无论溶液呈酸性、碱性还是中性,溶液一定是电中性的,即阳离子所带的正电荷总数与阴离子所带的负电荷总数相等。
1、酸碱指示剂
能跟酸或碱的溶液起作用而显示不同颜色的物质叫做酸碱指示剂。常用的酸碱指示剂有紫色石蕊试液和无色酚酞试液。
|
|
石蕊 |
酚酞 |
|
自身颜色 |
紫色 |
无色 |
|
遇酸 |
红色 |
无色 |
|
遇碱 |
蓝色 |
红色 |
2.现有一瓶无色溶液,设计实验证明它是硫酸。
1.常温下浓硫酸可以用铁桶盛装,但盛装过浓硫酸的铁桶用水清洗时要远离火源,用化学方程式表示其原因。
5. (兰州)某校化学课外活动小组在一次活动中,取刚降到地面的雨水水样,每隔5分钟用pH计测定一次pH,其数据如下表:
|
测定时刻 |
6︰05 |
6︰10 |
6︰15 |
6︰20 |
6︰25 |
6︰30 |
|
p H |
4.95 |
4.94 |
4.94 |
4.88 |
4.86 |
4.85 |
已知:正常雨水的pH约为5.6,酸雨的pH小于5.6。
(1)所取的雨水是否为酸雨? (填“是”或“否”);在测定的期间,雨水水样的酸性随着时间的变化逐渐 (填“增强”或“减弱”)。
(2) 经调查,这一地区有一座燃煤发电厂(生产过程中产生SO2),某同学设计用火碱来吸收生产过程中产生的SO2,将其转化成亚硫酸钠(Na2SO3)。请你帮他写出该反应的化学方程式: 。
(3)若用pH试纸测定雨水的酸碱度,测定方法是: 。
(1)是;增强。 (2)SO2 + 2NaOH == Na2SO3 + H2O
(3)(每空1分)用玻璃棒沾取雨水样品滴在pH试纸上,将pH试纸所显示的颜色与标准比色卡对比,读出数值
4.氢氧化钠是化学实验室中常用的试剂。
(1)氢氧化钠固体曝露在空气中,容易吸收水分而使表面覆盖一层溶液(这一现象又叫“潮解”);它还能 ,这一变化的化学方程式可表示为
。所以氢氧化钠固体必须密封保存。
(2)实验室盛放氢氧化钠溶液的试剂瓶不能用玻璃塞,其原因是在常温下,氢氧化钠与玻璃中的二氧化硅缓慢地发生反应,产物使瓶口与瓶塞粘合在一起,反应的化学方程式为:SiO2 + 2NaOH == X + H2O,试推断X的化学式为 。
2.工业品盐酸因含有杂质而显黄色。要除掉杂质得到纯净的盐酸,最合理的方法是________。
|
|
 。
。
|
|

 甲同学的方案:溶液 白色沉淀 沉淀不溶解
甲同学的方案:溶液 白色沉淀 沉淀不溶解

 乙同学的方案:溶液 无沉淀 白色沉淀
乙同学的方案:溶液 无沉淀 白色沉淀
试评价上述两个方案是否严密,并分别说明理由。
甲同学的方案______________________ 乙同学的方案______________________
1.烧水的铝壶中常结有一层水垢(主要成分为CaCO3)用适量的稀盐酸可以除去它,反应的化学方程式是________,若盐酸的用量过多,会损坏铝壶,反应的化学方程式是________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com