
题目列表(包括答案和解析)
3.今年5月21日至27日是全国第五届科技活动周,其主题是--保护生态环境,共建美好家园。下列做法有利于环境保护的是
①市区禁止摩托车通行 ②含汞电池集中处理 ③使用无铅汽油 ④不滥用塑料制品
⑤使用无氟冰箱 ⑥使用无磷洗衣粉 ⑦制止农民在田间焚烧农作物秸杆
A.①③⑤ B.②④⑥ C.③④⑦ D.①②③④⑤⑥⑦
2.继“分子足球”C60之后,科学家又发现另一种“分子足球”N60。一定条件下N60中积累的巨大能量会在一瞬间释放出来,是未来的火箭燃料,N60属于
A.金属单质 B.非金属单质 C.化合物 D.混合物
1.下列物质的用途与其物理性质有关的是
A.用生石灰作某些食品的干燥剂 B.白炽灯泡里涂上红磷作脱氧剂
C.用碳素墨水写文字档案便于保存 D.用活性炭除去冰箱异味
3 1.(4分)小强同学在公共场所围墙上看到一则化肥广告。
(1)回校后,小强通过计算氮的质量分数发现该广告是虚假广告。请你写出小强的计算过程和判
断依据。

(2)小强认为此广告会坑害农民,向有关部门反映,技术监督局对该产品取样分析,发现其氮元素质量分数仅为12.0%,则该产品中碳酸氢铵的质量分数为多少?
32.(7分)某化学兴趣小组在做Fe和CuS04溶液反应实验时,发现生成Cu的同时有气泡产生。为了进一步研究做了如下实验:
①取8.5g Fe粉放入一定量的CuS04溶液中,反应完成后,滤出固体,洗涤、干燥后称量,固体质量为9.2 g。
②将9.2g固体与一定质量分数的稀盐酸充分反应,消耗盐酸50.0 g,根据实验绘制反应产生氢气的质量与反应时间的关系图(见右图)。求:
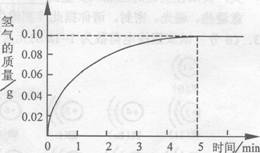 (1)稀盐酸的质量分数,与稀盐酸反应的Fe的质量。
(1)稀盐酸的质量分数,与稀盐酸反应的Fe的质量。
(2)与CuS04反应的Fe的质量。
(3)与CuS04反应的Fe的质量及与盐酸反应的Fe的质量之和_______8.5 g(选填“>”、“<”、“=”)。对此结果作出你的解释。
30.(6分)碳酸钙在高温下煅烧一段时间后,得到白色固体。两研究性学习小组的同学为了确定白色固体的成分,对其可能的组成进行探究。
[提出问题]白色固体的成分是什么?
I组:[作出猜想]白色固体的成分可能是CaC03和cao的混合物。
[实验验证](请你写出实验的步骤和现象):
_________________________________________________________________
[实验结论]白色固体的成分是CaC03和CaO的混合物。
II组:[作出猜想]白色固体可能全部是氧化钙。
[设计方案]取试样于试管中,加入水,再通入二氧化碳,变浑浊。
II组的方案正确吗?__________,理由是__________________________________
I组为了进一步研究碳酸钙分解的质量分数,设计了如下的实验方案:称取一定量白色固体,用足量盐酸溶解,产生的气体经除杂、__________后,被已称量好的足量的“吸收剂”吸收……“吸收剂”宜选用__________,该方案中还需补充的步骤是 _____________。
29.(7分)实验室中常用氯酸钾受热分解制取氧气。
(1)写出该反应的化学方程式____________________
(2)为组装制氧发生装置,请你从下图中选择所需的仪器(填序号,下同)___________。装药品前应首先进行 __________________。
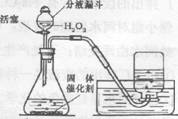
(3)实验室里还可采用右图装置,通过分解过氧化氢(H202)的方法制取氧气。
写出该反应的化学方程式:____________________
此装置中锥形瓶可用上图中的哪些仪器替代 ___________,收集氧气的方法还可以用________ 。右图发生装置还可用于制取的气体有________________ 。
28.(4分)实验是科学研究的重要手段,正确操作是获得成功的重要保证。请填空:
(1)熄灭酒精灯火焰时应 ________.
(2)读取量筒内液体体积时视线应_____________。
(3)用漏斗过滤时漏斗中液面不应______________。
(4)给试管内液体加热时,试管口不应_____________。
27.(2分)工人师傅配制溶质质量分数为9.8%的稀硫酸18.4kg,用于清洗钢铁表面的铁锈,需要溶质质量分数98%(密度为1.84g/cm3)浓硫酸的体积为________mL。
26.(4分)X是两种金属氧化物组成的混合物,为了研究混合物的成分,进行了如图所示的实验。

(1)x中含有的金属元素是 ______(填元素符号)。
(2)写出X中一种成分与盐酸反应的化学方程式:_________。
(3)若Y为固体,写出Y与X中一种成分反应的化学方程式 ______________;若Y为气体,Y还可以是__________(填化学式)。
25.(10分)水是宝贵的自然资源,在工农业生产和日常生活中有着极其广泛的应用。
(1)自来水的生产过程大体如下图:
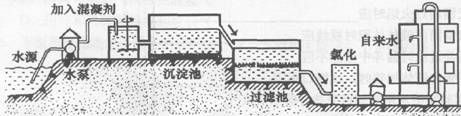
上图过滤池中有活性炭层,活性炭起 作用,该过程中发生______变化。氯化时,通常通入一定量氯气,它与水反应生成盐酸和次氯酸。实验室配制AgN03溶液时不宜使用自来水,其原因是(用化学方程式表示)________。高铁酸钾(K2Fe04)是一种理想的水处理剂,高铁酸钾中铁元素的化合价是_________。(2)电解水时,加入少量NaOH可以增强水的导电性。现将0.1gNaOH溶解在99.9g水里,接通直流电源后,与电源正极相连的一端放出的气体是_________,当溶液中NaOH的质量分数变为0.2%时,有____________水被分解。
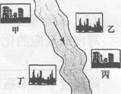
(3)在河旁有甲、乙、丙、丁四座工厂(位置如右图所示),每个工厂排出的废液只含有Na2C03、FeCl3、NaOH、HCl中的一种。某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清。请回答:
①甲工厂排出的废液是一种碱性物质,检验该物质呈碱性可选用的试剂是_________。
②乙处河水呈红褐色的化学方程式是________。
③丁处产生气泡的化学方程式是_______。
(4)保护水资源, 我们应该采取的措施是________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com