
题目列表(包括答案和解析)
1.(江苏南京中考)碳酸氢钠是生活中常见的盐,下列说法错误的是( )
A.发酵粉中含有碳酸氢钠,能使焙制出的糕点疏松多孔
B.干粉灭火器中含有碳酸氢钠,可用来扑灭油、气燃烧引起的火灾
C.碳酸氢钠和柠檬酸、水等混合可制成汽水
D.碳酸氢钠不能用作治疗胃酸过多的药剂
3.忽视基本题型的解题方法的总结和对比,造成复分解反应的相关规律的应用经常失误。
解答关于复分解反应的试题时,要注意对以下方面的一些知识点的梳理和方法的积累:①酸碱盐的溶解性,这是涉及到判断复分解反应的发生与否、溶液中物质或离子共存问题等的解题依据;②物质除杂的原则和方法,其原则为“不增、不减、易分、复原”即:不引入新的杂质,不减少主要成分的量,操作方法简单、容易将杂质分离,如果采用化学方法将主要成分变了,要能变回来;其方法为转化法和去除法;③物质推断的题型和方法,常规的题型有:表格型、叙述型、框图型等,推断题的解答思路是:寻找突破口-分析推导-验证确认。其中寻找突破口是关键,分析推导是难点,验证确认是保证。④物质鉴别的题型和方法,常规的题型有:不用任何试剂鉴别、只用一种试剂鉴别、用多种试剂鉴别,其中只用一种试剂鉴别题型频繁出现,其方法如下表:
|
鉴别物质的特征 |
方法和实例 |
|
难溶于水的多种物质的鉴别 |
根据其酸溶性或碱溶性来确定试剂。如鉴别木炭粉、铁粉、氧化铜、三种黑色粉末,可选用盐酸或稀硫酸。 |
|
易溶于水的多种酸、碱、盐的鉴别 |
根据物质的酸碱性不同选用适当的指示剂或PH试纸加以鉴别。如盐酸、氯化钠溶液、氢氧化钠溶液的鉴别,可选用石蕊试液。 根据阳离子对应碱的溶解性、颜色、稳定性等加以鉴别。如鉴别NaCl、MgCl2、NH4Cl、FeCl3四种溶液可选用氢氧化钠溶液。 |
[基础演练]
2.对不同形式的复分解反应发生的条件混淆不清,对反应物和生成物具备的条件没有进行区别和比较。如“酸和碱”和“盐和碱”发生复分解反应时,碱的溶解性要求不同,前者反应中的碱不一定可溶,后者反应中的碱一定可溶;“盐和盐”、“碱和盐”、“酸和盐”发生复分解反应时,盐的溶解性要求不同,前者和中间的反应中的碱一定可溶,后者反应中的碱不一定可溶。
1.忽视对基本常识和基本规律的记忆和积累,如常见盐的特征和用途、酸碱盐的溶解性等。
从以上例题中可以发现,很多试题(包括一些创新性和综合性的试题)的考查中都渗入了基本常识和基本规律。
6.利用酸碱盐之间的反应,考查化学计算,如例6。
[典例精析]
例1:(广东佛山中考)酒家在发酵面团中加入某种物质揉和,既能使蒸出的面包疏松多孔,又能除去面团中的酸,该物质可能是( )
A.白糖 B.NaHCO3 C.NaOH D.CH3COOH
解析 本题考查了生活中常见盐的用途。碳酸氢钠是焙制糕点所用的发酵粉的主要成分之一。在焙制面包时,加入的碳酸氢钠能与面团中的酸发生反应产生二氧化碳气体,既能使蒸出的面包疏松多孔,又能除去面团中的酸。
答案:B
例2:(广西南宁市课改实验区中考)下图给出三种物质,如果按概率统计,它们之间应该有六种相互转化的可能。请回答下列问题:
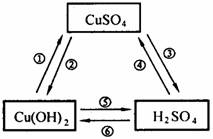
(1)不可能实现的转化关系是:___________________。(填序号)
(2)反应③可选择反应:H2S+CuSO4=H2SO4+CuS来实现。依据复分解反应的规律,生成物CuS必须具备的特性是_____________________、________________________。
(3)其余可实现的转化关系有_____________(填序号),可通过__________________(填反应类型)来实现。理由是______________________________________________。
解析 本题考查了复分解反应发生的条件,要求利用复分解反应发生的条件判断反应能否发生和推断相关物质的性质。
根据酸碱盐的性质,酸和碱之间不可能相互转化,因此不可能实现的转化关系为:⑤⑥。根据复分解反应发生的条件“生成物中有沉淀或有气体或有水生成”,结合“H2S+CuSO4=H2SO4+CuS”,可以推测CuS必须具备的特性为难溶于水且不溶于稀H2SO4。
答案:(1)⑤⑥ (2)难溶于水不溶于稀H2SO4(3)①②和④复分解反应 因为这三种物质分属酸、碱、盐,它们只需通过交换成分(离子)即可实现相互转化。
例3:(广东广州中考)有一包白色粉末可能由CaCO3、Na2SO4、BaCl2、NaCl中的一种或几种组成。把少量该粉末放入足量水中,搅拌、静置、过滤,得到白色固体和滤液。向所得固体中加入稀硝酸,固体溶解并有气体放出。向所得滤液中加入稀硫酸,有白色沉淀生成。该粉末中肯定没有的物质是( )
A.Na2SO4 B.CaCO3 C.BaCl2 D.NaCl
解析 本题考查了根据酸碱盐的性质进行混合物组成的推断。根据该白色粉末放入水中,得到白色固体和滤液,结合其可能组成可以推断白色固体可能为CaCO3或BaSO4。根据加入稀硝酸后固体溶解并有气体放出,可以推断该固体为CaCO3。根据Na2SO4和BaCl2二者不能共存,结合加入稀硫酸后滤液中有白色沉淀生成,可以推断粉末中一定含有Na2SO4而一定不含BaCl2。
答案:A
例4:(年天津中考)现有甲、乙两种溶液,共含有8种离子,分别为H+、Ag+、K+、Ba2+、OH-、Cl-、NO3-和CO32-,且两种溶液里所含的离子各不相同。已知向甲溶液里滴入紫色石蕊试液,溶液变成蓝色,说明甲溶液呈 (填“酸性”、“碱性”或“中性”),那么乙溶液里含有的4种离子是(填离子符号) 。
解析 本题考查了应用复分解反应判断离子能否大量共存,从而推断溶液的组成。根据甲溶液滴入紫色石蕊试液变蓝,可以推断甲溶液为碱性溶液。因此甲溶液中一定含有OH-,则乙溶液中一定含有H+(H+和OH-不能共存)。根据Ag+和OH-不能共存,H+和CO32-不能共存,可以推断出甲含有CO32-,乙含有Ag+;根据Ag+和Cl-不能共存,CO32-和Ba2+不能共存,可以推断出甲含有Cl-,乙含有Ba2+;根据溶液电中性,甲溶液中一定含有阳离子K+,乙溶液中一定含有阴离子NO3-。
答案:H+、Ag+、Ba2+、NO3-
例5:(湖北武汉中考)利用右图所示装置进行实验(该装置气密性完好)
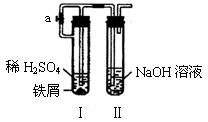
(1)打开止水夹a,装入药品后连接装置,可观察到试管Ⅰ中发生的现象 _________________ ____;引起该现象的原因是 ___________________________。
(2)当试管Ⅰ中的反应进行到一定时间时,夹紧止水夹,试管中有沉淀生成。原因是________________________。
解析 本题将酸碱盐的化学反应和压强原理相结合,考查了综合实验分析的能力。打开止水夹a,试管Ⅰ、Ⅱ与外界大气压相通,装入药品后发生反应:Fe+H2SO4=FeSO4+H2↑,试管Ⅰ中有气泡产生;夹紧止水夹a,随着反应的发生,试管Ⅰ中压强增大,将反应生成的FeSO4压入试管Ⅱ中,FeSO4与NaOH发生反应:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,试管Ⅱ中有沉淀生成。
答案:(1)有气泡生成,铁与稀硫酸反应生成了氢气 (2)试管Ⅰ中反应生成的硫酸亚铁溶液通过导管进入Ⅱ中,与氢氧化钠溶液反应生成氢氧化亚铁沉淀(用化学方程式表示也可)
例6:(湖北荆州中考)为测定某Na2CO3样品(混有KCl)中Na2CO3的质量分数,甲、乙两同学分别设计了以下方案:
(1)甲同学称取样品11.8 g,于烧杯中加水溶解后向其中加入过量的16%的CaCl2溶液,充分反应后将生成的沉淀过滤、洗涤、干燥,称其质量为1.00 g,试通过计算确定样品中Na2CO3的质量分数ω(Na2CO3)。(用百分数表示,结果保留1位小数)
(2)乙同学同样取样品11.8g,于烧杯中加水溶解后向其中加入一定量10%的盐酸溶液,充分反应,通过测定生成的CO2的质量来确定Na2CO3的质量分数。试计算反应到少需要该盐酸溶液多少g?
解析 本题以Na2CO3样品中Na2CO3的质量分数的测定为载体,考查了运用盐的化学性质(与盐、酸的反应)进行化学计算的能力。
方案(1)中运用的原理是:Na2CO3+CaCl2=CaCO3↓+2NaCl,根据产生沉淀的质量来确定Na2CO3的质量分数。设设样品中含Na2CO3的质量为x。根据反应中的定量关系,则
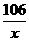 =
=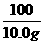 x=
x= =10.6g
=10.6g
样品中Na2CO3的质量分数为ω(Na2CO3)=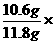 100%=89.8%
100%=89.8%
方案(2)中运用的原理是:Na2CO3+2HCl=2NaCl+CO2↑+H2O,根据生成的CO2的质量来确定Na2CO3的质量分数。设至少需要10%的盐酸溶液的质量为y。根据反应中的定量关系,则
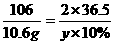
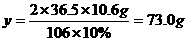
答案:(1)89.8% (2)73.0g
[常见误区]
5.利用酸碱盐的化学性质和转化关系,考查物质的制备和综合实验,如例5;
4.根据复分解反应发生的条件,考查溶液中物质或离子的共存,如例4;
3.利用酸碱盐之间的反应规律,考查混合物的分离、提纯和混合物组成的推断,如例3;
2.利用酸碱盐之间的相互转化关系,考查复分解反应发生的条件,如例2;
1.以常见盐的性质,考查常见盐的用途和鉴别,如例1;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com