
题目列表(包括答案和解析)
3.下列计算或结果正确的是 ( )
A.Ca(OH)2的相对分子质量=40+16+1×2=58
B.SO2中硫元素与氧元素的质量比是2:1
C.CO2中氧元素的质量分数 ×100%
×100%
D.54g水中含有氢元素6g
答案:D
2.下列符号能代表2个分子的是 ( )
A.MgCl2 B.Re2O3 C.2O2 D.2Al
答案:C
1.关于“H2”表示的意义,下列说法错误的是 ( )
A.表示氢气这种物质 B.表示2个氢气原子
C.表示1个氢气分子 D.表示每个氢分子是由2个氢原子构成的
答案:B
2.防锈的方法:保持干燥;隔绝氧气
1.铁的锈蚀条件:有水和氧气
2.合金的形成条件:其中任一金属的熔点不能高于另一金属的沸点(当两种金属形成合金时)。
考点2 金属与氧气的反应
|
金属 |
条件 |
反应方程式 |
现象 |
|
Mg |
常温下(在空气中 |
2Mg+O2 =2MgO |
银白色镁条在空气中表面逐渐变暗,生成白色固体。 |
|
点燃时(在空气中或在氧气中) |
点燃 2Mg+O2 ======2MgO |
剧烈燃烧,发出耀眼的白光,生成一种白色固体。 |
|
|
Al |
常温下(在空气中) |
4Al+3O2 =2Al2O3 |
银白色的表面逐渐变暗,生成一层致密的薄膜。 |
|
点燃时(在氧气中) |
点燃 4Al+3O2 ====2Al2O3 |
剧烈燃烧,放出大量的热和耀眼的白光,生成白色固体。 |
|
|
Fe |
常温下,干燥的空气 |
|
|
|
常温下,在潮湿的空气中 |
铁与空气中的氧气和水共同作用下会生成暗红色疏松的物质--铁锈(Fe2O3·H2O) |
||
|
在氧气中点燃 |
点燃 3Fe+2O2 ======Fe3O4 |
剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体。 |
|
|
Cu |
常温下,干燥的空气 |
|
|
|
加热时 |
△ 2Cu+O2 =====2CuO |
铜丝表面逐渐变为黑色 |
|
|
在潮湿的空气中 |
2Cu+O2+CO2+H2O=Cu2(OH)2CO3 |
铜表面生成一层绿色物质 |
|
|
Au、Ag |
即使在高温下也不与氧气反应“真金不怕火炼”。 |
||
|
结论:大多数金属都能与氧气反应,但反应的难易和剧烈程度不同。Mg、Al等在常温下就能与氧气反应;Fe、Cu等在常温下几乎不能单独与氧气反应,但在点燃或加热的情况下可以发生反应;Au、Ag等在高温时也不与氧气反应。 |
考点3金属与酸的反应
|
金属 |
现象 |
反应的化学方程式 |
||
|
稀盐酸 |
稀硫酸 |
稀盐酸 |
稀硫酸 |
|
|
镁 |
剧烈反应,产生大量气泡,溶液仍为无色,试管壁发热,生成的气体能够燃烧并且产生淡蓝色火焰。 |
Mg+2HCl =MgCl2+H2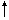 |
Mg+H2SO4=MgSO4+H2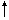 |
|
|
锌 |
反应比较剧烈,产生大量气泡,溶液仍为无色,试管壁发热,生成的气体能够燃烧并且产生淡蓝色火焰。 |
Zn+2HCl =ZnCl2+H2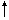 |
Zn+H2SO4=ZnSO4+H2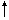 |
|
|
铁 |
反应缓慢,有气泡产生,溶液由无色逐渐变为浅绿色,生成气体能够燃烧并且产生淡蓝色火焰。 |
Fe+2HCl =FeCl2+H2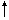 |
Fe+H2SO4 =FeSO4+H2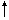 |
|
|
铜 |
不反应 |
|
|
|
|
结论:Mg、Zn、Fe的金属活动性比铜强,它们能置换出稀硫酸或稀盐酸中的氢。 |
||||
考点4 金属与化合物溶液的反应
|
实验操作 |
现象 |
反应的化学方程式 |
质量变化 |
应用 |
|
铁丝浸入硫酸铜溶液中 |
浸入溶液的铁钉表面覆盖一层紫红色的物质,溶液由蓝色逐渐变为浅绿色 |
Fe+CuSO4= Cu+FeSO4 |
金属质量增加,溶液质量减少 |
不能用铁制品放硫酸铜溶液(或农药波尔多液) |
|
铝丝浸入硫酸铜溶液中 |
浸入溶液的铝丝表面覆盖一层紫红色的物质,溶液由蓝色逐渐变为无色 |
2Al+3CuSO4=Al2(SO4)3+3Cu |
金属质量增加,溶液质量减少 |
|
|
铜丝浸入硝酸银溶液中 |
浸入溶液的铜丝表面覆盖一层银白色的物质,溶液由无色逐渐变为蓝色 |
Cu+2AgNO3=Cu(NO3)2+2Ag |
金属质量增加,溶液质量减少 |
|
|
铜丝浸入硫酸铝溶液中 |
|
|
|
|
|
结论:1.以上四种金属的活动性由强到弱的顺序为:Al>Fe>Cu>Ag 2.活泼性强的金属能把活泼性弱的金属从其化合物溶液中置换出来。 |
||||
|
注意:1.此类反应一定在溶液中进行,不溶于水的化合物一般不与金属反应。 2. K、Ca、Na活动性非常强,但不能用它们置换化合物中的金属,因为它们能同溶液中的水剧烈反应。 |
考点5 金属活动性顺序
人们通过大量的实验验证得到常见金属的活动性顺序:
 K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt
Au
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt
Au
金属活动性:由强到弱
应用:
在金属活动性顺序里,金属的位置越靠前,它的活动性越强。
在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢。
在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来(K、Ca、Na除外)。
考点6 一氧化碳还原氧化铁
(1)仪器:铁架台(2个)、硬质玻璃管、单孔橡皮赛(2个)、酒精灯、试管、酒精喷灯、双孔橡皮赛、导气管。
(2)药品:氧化铁粉末、澄清石灰水、一氧化碳气体
(3)装置图:

(4)步骤:①检验装置的气密性;②装入药品并固定;③向玻璃管内通入一氧化碳气体;④给氧化铁加热;⑤停止加热;⑥停止通入一氧化碳。
(5)现象:红色粉末逐渐变成黑色,澄清石灰水变浑浊,尾气燃烧产生蓝色火焰。
高温 点燃
(6)化学方程式:3CO+Fe2O3====2Fe+3CO2 2CO+O2=====2CO2
Ca(OH)2+CO2=CaCO3↓+H2O
(7)注意事项:与CO还原氧化铜的实验操作顺序一样,即先通入CO再加热,实验完毕,停止加热,继续通入CO至试管冷却。
(8)尾气处理:因CO有毒,不能随意排放在空气中,处理的原则是将CO燃烧掉转化为无毒的CO2或收集备用。
考点7 金属的锈蚀和保护
9.在下列示意图表示的粒子中,属于原子的有(用序号填空,下同)________,属于阴离子的有________,属于阳离子的有________,属于同种元素的有________,达到稳定结构的有________,具有相同的电子层结构的是________。

通过以上各图还可总结出,原子和离子的区别在于:
(1)________________________________________________________________。
(2)________________________________________________________________。
(3)________________________________________________________________。
思路解析:同种元素的粒子,质子数必相同。由于原子呈电中性,对阳离子而言,核电荷数必大于核外电子数。问题的关键是如何找出原子和离子的区别,可以从质子数与核外电子的关系、粒子的带电性等方面加以考虑。
答案:②⑤⑥ ③ ①④ ④⑤ ①③④⑥ ?①③④
(1)原子整体上不显电性,离子显电性
(2)原子中质子数等于电子数,离子中质子数不等于电子数
(3)离子的最外层电子数一般是8电子(只有一个电子层时为2电子)的相对稳定结构,原子中除稀有气体外,其余的一般不是相对稳定结构
8.元素Z的核电荷数为8,阴离子Z2-与元素Y的阳离子Y3+的电子层结构相同,则元素Y的核电荷数是_________。
思路解析:离子是由原子失去或得到电子而形成的,且离子所带的电荷数等于原子形成离子时失去或得到的电子的数目,又Z2-的核外电子数为8+2=10,设Y的核电荷数为b,则Y3+核外电子数为b-3,又Z2-与Y3+电子层结构相同,则8+2=b-3,因此b=8+2+3=13。
答案:13
我创新 我超越
7.根据粒子结构示意图给出的信息,下列说法正确的是( )

A.①②③表示的是三个原子 B.③表示的元素是非金属元素
C.①③表示的是阳离子 D.①②表示的元素化学性质相似
思路解析:此题根据粒子结构示意图,判断元素种类、粒子种类、元素的性质以及结构的稳定性。解题的关键在于:
(1)由质子数和电子数的差值判断粒子种类(原子、阳离子、阴离子),①②为原子,而③为阳离子。
(2)由核内质子数决定元素种类,核内质子数不同,则表示不同元素。
(3)由原子最外层电子数决定元素的性质,①②为非金属元素,③为金属元素。且最外层电子数相同,性质相似,如①②元素化学性质相似。
(4)由最外层电子数决定粒子结构的稳定性。一般最外层电子数为8的结构称为“8电子稳定结构”。
答案:D
6.某粒子由12个质子、12个中子和10个电子构成,该粒子是( )
A.分子 B.原子 C.阴离子 D.阳离子
思路解析:此题考查由粒子中质子数、电子数的关系去判断粒子种类的能力。解此题的关键在于要明确判断粒子种类(分子、原子、阴离子、阳离子)的依据是粒子中质子数和电子数的大小。当质子数=电子数时,呈中性,为分子、原子;当质子数>电子数时,带正电荷,为阳离子;当质子数<电子数时,带负电,为阴离子。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com