
题目列表(包括答案和解析)
2.解 溶质的质量分数=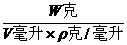 ×100%=
×100%=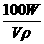 %
%
该湿度下的溶解度
溶质 溶剂 溶液
W克 Vρ-W克 Vρ克
S 100克
则S=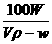 克
克
1.分析 在一定湿度下不饱和溶液蒸发溶剂没有晶体析出,只能使溶液浓缩,当继续蒸发形成饱和溶液后,再蒸发溶剂,过多的溶质就会析出。60℃的硝酸钾溶液500克未注明是否饱和,若为饱和溶液析出晶体的质量为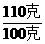 =
= x=11克;若为不饱和溶液析出晶体的质量将小于11克,甚至没有晶体析出。
x=11克;若为不饱和溶液析出晶体的质量将小于11克,甚至没有晶体析出。
解 应选C。
7.质量分数为63%的硝酸W克,跟质量分数为56%的氢氧化钾溶液恰好完全反应。求
(1)该氢氧化钾溶液的质量;
(2)反应后溶液中水的质量;
(3)欲在38℃获得0.5W克硝酸钾晶体,需蒸发的水的质量(38℃时硝酸钾的溶解度是60克)
答案与提示
6.将11.2克氧化钙加到50克盐酸中,使氧化钙完全反应,此时溶液的pH值小于,当再加入4克10%的氢氧化钠溶液,溶液的pH值等于7,求此盐酸的溶质的质量分数。
5.某一价金属硫酸盐的结晶水合物6.44克,加热到结晶水全部失去,其质量减少55.9%。将加热后的固体全部溶于水,加入过量的氯化钡可得到沉淀4.66克,通过计算(查原子量表)确定结晶水合物的化学式。
4.向25.8克含有少量NaCl杂质的Na2CO3的白色固体中,慢慢加入10%的稀盐酸到恰好不再产生气体为止,共收集到干燥的CO2气体8.8克。求:
(1)白色固体中Na2CO3的质量是多少?
(2)所得溶液中NaCl的质量分数是多少?
(3)若要使所得溶液在20℃时成为饱和溶液,还需加入NaCl固体的质量是多少?(20℃时NaCl的溶液度为36克).
3.将t℃时质量分数为40%的KNO3溶液100克,恒温蒸发掉20克水,析出晶体1克。
求:(1)t℃时KNO3的溶解度
(2)t℃时在100克40%的KNO3溶液中加入多少克KNO3,恰好达到饱和?
2.将W克某物质完全溶于水中,得到20℃时V毫升饱和溶液,若该溶液的密度为( )克/毫升,则此溶液溶质质量分数为__________,该湿度下的溶解度为___________.
(2)m为4.4g
(3)设矿石中CaCO3的质量为x。以第一次实验结果计算。
CaCO3+2HCl===CaCl2+H2O+CO2↑
100 44
x 1.76g
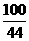 =
=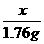 x=4g
x=4g
故矿石中碳酸钙的质量分数= ×100%=80%
×100%=80%
例4. (2002年山西省中考题)
某样品为铜和氧化铜的混合物,为测定该样品中氧化铜的含量,取用20g此样品,分四次向其中加入稀盐酸与之充分反应。每次所用盐酸的体积与反应后剩余固体的质量见下表:
|
第次 |
加入稀盐酸的体积/mL |
剩余固体的质量/g |
|
1 |
40 |
16 |
|
2 |
40 |
12 |
|
3 |
40 |
8 |
|
4 |
40 |
8 |
试求:
(1)20g样品中铜的质量
(2)样品中氧化铜的质量分数
(3)用氢气充分还原5g此样品,可得到固体的质量。
[解析]。(1)第三、四次剩余固体均为8g,说明该剩余固体不能与盐酸反应,它一定是铜。因此20g样品中铜的质量为8g。
(2)CuO的质量分数: ×100%=60%
×100%=60%
 (3)设用氢气还原5g样品生成铜的质量为x。
(3)设用氢气还原5g样品生成铜的质量为x。
H2+CuO H2O+Cu
80 64
5g×60% x
=3g
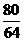 =
=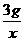 x=2.4g
x=2.4g
可得固体质量:2.4g+(5g-3g)=4.4g
答:20g样品中铜的质量为8g,氧化铜的质量分数为60%,用氢气充分还原5g此样品只可得铜4.4g.
习题精练
1.已知60℃时硝酸钾的溶解度为110克,现有500克60℃的硝酸钾溶液,若蒸发掉10克水,湿度恢复到60℃不可能有的情况是( )
A.析出硝酸钾晶体的质量等于11克 B.析出硝酸钾晶体的质量小于11克
C.析出硝酸钾晶体的质量大于11克 D.没有硝酸钾晶体析出
(三)在一道计算题中若同时包含了两种或两种以上的基本计算类型,就属于综合计算,主要类型如下:
1.化学式计算与化学方程式计算的综合
2.溶解度与饱和溶液溶质的质量分数的换算
3.化学方程式计算与溶液计算的综合
其中最常邮的是第3种类型,这类计算的类型有:
(1)先根据化学方程式进行计算,将求得的有关纯物质质量作为溶质,再时行关于溶质的质量分数或溶解度的计算,若反应物彼此恰好完全反应,求反应后所得溶液溶质的质量分数时,找准溶液的质量是解题的关键,有两种方法。
质量守恒:
溶液质量=反应物质质量总和-脱离溶液的质量(气体、沉淀、析出晶体、不容杂质等)
溶液组成法:
溶液质量=溶质质量(根据方程式求算)+溶剂质量(原反应物溶液中的水+化学反应中生成的水)
一般用第一种方法计算较为简便。
(3)先根据溶质的质量分数和溶液质量算出溶质质量,再代入化学方程式进行有关计算。
综合计算涉及的概念较多,头绪繁杂,在审题时要善于化繁为简,把复杂问题分解成几个简单问题求解。同时在解题过程中要做到思路清晰、步骤完整、计算准确、格式规范,还要注意单位和精确度要求。
例1.(2002 北京市四城区中考题)
实验定有一瓶存放时间较长的氢氧化钠,其中的一部分已转化成碳酸钠,现要用该药品配制10%的氢氧化钠溶液。取50.6g该药品,溶于200mL水中,然后慢慢地滴入17.1%的氢氧化钡溶液,当用去100g氢氧化钡溶液时,碳酸钠恰好反应完全。求:
(1)50.6该药品中碳酸钠的质量。
(2)滤出沉淀后所得溶液中溶质的质量和溶液的质量。
(3)向所提溶液中再加入多少毫升水才能配制成10%的氢氧化钠溶液。
[解析]这是一道涉及到溶液和化学方程式的综合计算题。
设50.6g该药品中碳酸钠的质量为x,生成碳酸钡和氢氧钠的质量分别为y和z.
(1)Ba(OH)2的质量=100g×17.1%=17.1g
Na2CO3+Ba(OH)2===BaCO3↓+2NaOH
106 171 197 80
x 17.1g y z
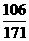 =
=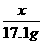 x=10.6g
x=10.6g
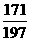 =
= y=19.7g
y=19.7g
 =
=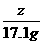 z=8g
z=8g
(2)NaOH溶液中溶质的质量为:
50.6g-10.6g+8g=48g
NaOH溶液的质量为:
50.6g+200mL×1g/mL+100g-19.7g=300.9g
(3)需加入水的体积为:
(48g÷10%-330.9g)÷1g/mL=149.1mL
答:略
例2.(2002年 福建省泉州市中考题)
工业上常用废铜屑跟热的稀硫酸和氧气反应制取硫酸铜:
2Cu+O2+2H2SO4===2CuSO4+2H2O 现将25.6吨废铜屑和368吨热的稀硫酸混合,通入足量的氧气,恰好完全反应。试计算:
(1)参加反应的氧气有多少吨?
(2)可制得我水硫酸铜多少吨?
(3)反应后溶液中CuSO4的质量分数是多少?
[解析] 尽管这个化学反应是新遇到的,但是所涉及的计算步骤和方法应该是熟悉的。
 设参加反应的O2的质量为x,生成的CuSO4质量为y.
设参加反应的O2的质量为x,生成的CuSO4质量为y.
2Cu + O2+2H2SO4 2CuSO4+2H2O
2×64 32 2×160
25.6T x y
 =
= x=6.4T
x=6.4T
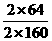 =
= y=64T
y=64T
CuSO4的质量分数=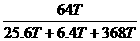 ×100%=16%
×100%=16%
答:参加反应的O2有6.4T;可制得无水硫酸铜的64T;CuSO4溶液中溶南的质量分数为16%。
例3.(2002年,安徽省中考题)
石灰石是我省的主要矿产之一。学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g。平均生成4份,进行实验,结果如下:
|
实验 |
1 |
2 |
3 |
4 |
|
加入样品的质量/g |
5 |
10 |
15 |
20 |
|
生成CO2的质量/g |
1.76 |
3.52 |
4.4 |
m |
(1)哪几次反应中矿石有剩余?_______________________________________。
(2)上表中m的数值是_______________________________。
(3)试计算这种石灰石矿中碳酸钙的质量分数。
[解析] 要善于分的所给的实验数据,并能透过现象看本质。将稀盐酸分成4分,每份为50g。
第一次加入5g样品生成1.76gCO2,而第二次加入10g样品,生成CO2的质量为1.76g×2=3.52g,第三次加入15g样品,生成CO2的质量为4.4g≠1.76g×3,说明从第三次开始,样品均过量。即产生CO2的量决定于盐酸的量。由此可见:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com