
题目列表(包括答案和解析)
1.2克 Y2 Y2=4.4克
一氧化碳的质量分数=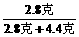 ×100%=38.9%
×100%=38.9%
(2)设生成碳酸钙质量为Z.
Ca(OH)2 + CO2 = CaCO3↓ + H2O
44 100
Y1+Y2=8.8克 Z
Z=20克
答:略.
[习题精练]
2.代入方程式计算的量必须是参加反应的纯净物质的质量
对于题设所给的物质质量,先要根据“完全反应”、“足量”等关键词判断是否全部参加反应,没有全部参加反应的量不能代入方程式;还要判断是否为纯物质,如所给的是混合物,可通过以下公式换算为纯净物;纯物质的质量=不纯物质的质量×某物质的纯度.
如题设所给的是气体的体积,不能直接代入方程式计算,应通过以下公式换算成质量后方可代入:气体的质量=气体的体积×气体的密度.
此外,应注意代入方程式中质量单位要统一.
[典型题例]
例1 求Na2CO3·10H2O的相对分子质量
解 Na2CO3·10H2O的相对分子质量=23×2+12×1+16×3+10×(1×2+16×1)=286
例2 求葡萄糖(C6H12O6)中各元素的质量比
解 C:H:O=12×6:1×12:16×6=6:1:8
例3 求硝酸铵(NH4NO3)中氮元素的质量分数
解
氮元素的质量分数= ×100%
×100%
= ×100%=35%.
×100%=35%.
例4 已知化合物M由氮和氧两种元素组成,已知380克M中含140克氮,求M的化学式.
解法一 设M的化学式为NxOy,则
380克× =140克
=140克
380克×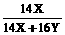 =140克
=140克 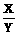 =
=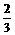 .
.
M的化学式为N2O3.
 解法二 由题意380克M中含(380克-140克)氧,则氮、氧元素质量比=140:240=7:12.
解法二 由题意380克M中含(380克-140克)氧,则氮、氧元素质量比=140:240=7:12.
 氮、氧原子个数比= =
氮、氧原子个数比= =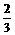 .
.
M的化学式为N2O3.
例5 某硝酸铵样品,经实验分析氮元素质量分数为33.6%,计算该样品中硝酸铵的质量分数.(设杂质不含氮)
解法一 设样品质量为100克,其中含硝酸铵质量为X,则:
X· =100克×33.6%
X=96克
=100克×33.6%
X=96克
硝酸铵的质量分数=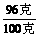 ×100%=96%
×100%=96%
解法二 硝酸铵的质量分数=
= ×100%=96%.
×100%=96%.
例6 尿素的化学式为CO(NH2)2 (1)求等质量的尿素与硝酸铵中氮元素的质量比.(2)100千克尿素含氮量与多少千克NH4HCO3含氮量相等?
解 (1)设尿素与硝酸铵的质量都等于M
M× :M×
:M× =
=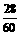 :
: =
=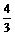 .
.
(2)设质量为X的NH4HCO3含氮量与100千克尿素含氮量相等
X· =100千克×
=100千克×
X=263千克.
例7 某不纯的MnO2粉末,其中只含一种杂质,经测定含氧质量分数为35.8%,则这种杂质可能是( )
A.MgO B.SiO2 C.CuO D.铁粉
解析 MnO2中氧元素质量分数=36.8%,高于样品的含氧量,因此杂质中氧元素质量分数应一定小于35.8%,否则样品的含氧质量分数不可能等于35.8%.将四个选项物质的含氧量分别算出(MgO:40%; SiO2:53.3%; CuO:20%; 铁粉:0%)故应选C、D.
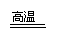
例8 一氧化碳能在高温下还原铁矿石中的氧化铁.用100吨含Fe2O3为80%的铁矿石炼铁,可炼出含铁95%的生铁多少吨?
 解法一 设可炼出生铁质量为X
解法一 设可炼出生铁质量为X
3CO+Fe2O3 2Fe+3CO2
160 112
100吨×80% X·95%
X=58.9吨
解法二 铁矿石中的铁元素在反应前后没有改变,可根据铁矿石和生铁中铁元素质量相等求解.设可炼出生铁质量为X,则:
100吨×80%× =X·95%
=X·95%
X=58.9吨
答:略.
例9 有13.5克干燥纯净的KClO3和MnO2的混合物,其中MnO2的质量分数为20%.把混合物放在试管中加热,当测得MnO2的质量分数占剩余固体的27%时,求已经分解的KClO3质量.
解 MnO2的质量=13.5 克×20%=2.7克
MnO2是催化剂,质量保持不变.则剩余固体质量=2.7克÷27%=10克
根据质量守恒定律,生成氧气的质量=13.5克-10克=3.5克
|
|
 2KClO3 2KCl+3O2↑
2KClO3 2KCl+3O2↑
245 96
X 3.5克
X=8.9克
答:略.
例10 将金属混合物6.63克跟足量稀硫酸反应生成0.3克氢气,则该金属粉末可能是
( )
A.Mg和Fe B.Mg和Al C.Fe和Zn D.Mg和Zn
解析 求该金属混合物的可能组成,这是一道典型的估算题.
先根据化学方程式计算出生成0.3克H2需Mg:3.6克,Fe:8.4克,Zn:9.75克,Al:2.7克(也可根据公式:金属与足量酸反应生成氢气质量= ×金属质量求解.)根据平均组成法,只有一种大于6.63克,一种小于6.63克才有可能.因此选A、D.
×金属质量求解.)根据平均组成法,只有一种大于6.63克,一种小于6.63克才有可能.因此选A、D.
例11 将一定质量的CaCO3和Cu粉置于同一敞口容器中,加热煅烧使其完全反应,反应前后容器内固体的质量不变,则容器中Cu和CaCO3的质量比是( )
A.11:4 B.20:14 C.44:25 D.16:25
解析 对于无数据计算,通过巧设未知量,化抽象为具体,再通过巧抓不变量,找出解决问题的突破口,列出等式.本题发生了两个反应,CaCO3分解造成固体质量减少,减少的质量等于生成的CO2质量,Cu和O2反应造成固体质量增加,增加的质量等于O2质量,由题意CO2质量等于参加反应的O2质量.
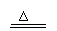
 设CaCO3质量为x,Cu质量为y
设CaCO3质量为x,Cu质量为y
CaCO3 CaO+CO2↑ 2Cu + O2 2CuO
100 44 128 32
x
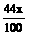 y
y 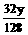
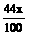 =
=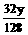
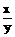 =
= . 答:略.
. 答:略.
例12 将2.4克木炭(不含其它杂质)在氧气中燃烧,反应后气体中不含氧气,当气流通过灼热的氧化铜和足量的石灰水,气体被全部反应完,测知生成铜6.4克.试求(1)气流中一氧化碳的质量分数.(2)生成碳酸钙的质量.
 解
(1)设一氧化碳质量为x,该反应中生成的CO2质量为Y1
解
(1)设一氧化碳质量为x,该反应中生成的CO2质量为Y1
CuO + CO Cu + CO2
28 64 44
X 6.4克 Y1
X=2.8克 Y1=4.4克
生成2.8克CO消耗C:2.8克× =1.2克,还有(2.4克-1.2克)=1.2克,木炭燃烧生成CO2,设生成CO2质量为Y2.
=1.2克,还有(2.4克-1.2克)=1.2克,木炭燃烧生成CO2,设生成CO2质量为Y2.
 C
+ O2 CO2
C
+ O2 CO2
12克 44
1.掌握正确的解题程序和书写格式
解题一般按以下程序:审题→写出配平的化学方程式→找出关系量→列比例式→求解.
格式的基本要求是步骤严谨、层次分明,一般可按照“解”、“设”、“写”(化学方程式)、“列”(比例式)、“解”(比例式)、“答”(六步来写).
6.注意几个问题
5.足量:有时指适量,有时指过量.其作用在于说明另一反应物已全部反应完.
4.过量:反应完全后,有一种或几种反应物剩余.
3.适量:两种或几种反应物相互反应,按照一定的质量比恰好完全反应.
2.完全反应:反应物全部反应完了,反应结束后,没有剩余的反应物.
1.反应完全(充分反应);反应物之间可以反应的都相互反应了,反应结束后,反应物可能有剩余,也可能没有剩余.
5.审题时明确几个概念
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com