
题目列表(包括答案和解析)
1.[05汕头]我们的地球表面3/4被水覆盖,但是世界上有20多亿人口面临淡水危机,减少污染和节约用水是解决这一危机的重要措施。请回答:
⑴水体污染的主要来源是__________、工业“三废”、农业污染。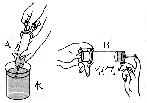
⑵列举节约用水的两种方法_______________________________。
34.甲、乙、丙三个同学用下列试剂分进行实验,均恰好反应完全。所用试剂及质量见下表:

已知a1+a2+a3=21.9,b1+b2+b3=182.5,现将甲、乙、丙三位同学所得溶液全部倒入一容器内,称得此溶液质量为200g。
试求:⑴a3,b3的值;
⑵此混合溶液中溶质的质量分数。(精确到0.1%)
33.将10g不纯的锌粒(杂质不溶于水也不溶于酸)投入到100g稀硫酸中完全反应,得到了0.2g气体。试计算:
(1)锌粒的纯度;
(2)参加反应的稀硫酸的质量分数;
(3)反应得到的溶液的溶质质量分数;
(4)如果我们要用98%的浓硫酸来配制500g反应使用的稀硫酸,需要浓硫酸多少毫升?水多少毫升?(浓硫酸的密度为1.84g/mL)
32.用含有二氧化碳和水蒸气杂质的某种还原性气体测定一种铁的氧化物(FexOy)的组成,实验装置如图所示。
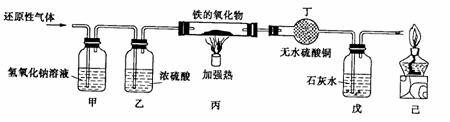
(1)甲装置的作用是 ,反应的化学方程式是 .
(2)如果将甲装置和乙装置位置的顺序调换,对实验 (填有或无)影响
(3)实验过程中丁装置中没有明显变化,而戊装置中溶液出现了白色沉淀,则该还原性气体是 ;
(4)当丙装置中的FexOy全部被还原后,称量剩余固体的质量为16.8g,同时测得戊装置的质量增加了17.6g,则FexOy中,铁元素和氧元素的质量比为 ,该铁的氧化物的化学式为 。
(5)上述实验装置中,如果没有甲装置,将使测定结果中铁元素与氧元素的质量的比值
(填“偏大”、“偏小”或“无影响”);如果没有己装置,可能产生的后果是 。
31、 实验室提供以下所示的常见仪器,供完成下列气体制取实验时选用。
实验室提供以下所示的常见仪器,供完成下列气体制取实验时选用。
(1)写出下列仪器的名称:A B D H
(2)实验室采用加热高锰酸钾制取O2并用排水法收集O2时,必须选用上述仪器中的 (填序号),反应化学方程式为为 。
(3)过氧化氢(H2O2)俗称双氧水,常温下是一种无色液体,它在二氧化锰的催化作用下能迅速分解,生成水和氧气。写出该反应的化学方程式 。若实验室采用该反应来制取O2,并且在实验过程中可以随时添加双氧水,则气体发生装置必须选用上述仪器中的
(填序号)。
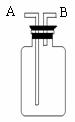 (4)氨气(NH3)是一种密度比空气小,极易溶于水的气体,实验室常用固体NH4Cl和固体Ca(OH)2加热制得NH3,同时得到氯化钙和水,该反应的化学方程式为
,实验制取和收集NH3必须选用上述仪器中的
(填序号)。
(4)氨气(NH3)是一种密度比空气小,极易溶于水的气体,实验室常用固体NH4Cl和固体Ca(OH)2加热制得NH3,同时得到氯化钙和水,该反应的化学方程式为
,实验制取和收集NH3必须选用上述仪器中的
(填序号)。
(5)若直接使用右图所示装置收集O2,
O2由 口进入;若在装置中充满水,则
O2应由 口进入(填编号)。
29根据下表填空
|
气体 |
二氧化氮 |
 一氧化氮 一氧化氮 |
|
颜色 |
棕色 |
无色 |
|
溶解性 |
易溶于水 |
微溶于水 |
|
反应 |
3NO2+H2O==2HNO3+NO |
(HNO3,即硝酸,是化学常见的强酸之一,易溶于水)
如右图所示,将一支充满二氧化氮的棕色气体的试管倒立在水槽中,试描述试管内可能出现的实验现象。
①________________________________②_______________________________。
30.某学习小组为探究金属的性质,将一根铝条放入盛有稀盐酸的试管中,实验现象记录如下:
|
反应时间/min |
1 |
5 |
8 |
10 |
13 |
15 |
|
实验现象 |
少量 气泡 |
较多 气泡 |
大量 气泡 |
反应 剧烈 |
少量 气泡 |
反应停止 铝条剩余 |
试解释上述实验过程中,产生一系列现象的原因:
。
28.试简答或解释下列生活现象:
(1)春暖花开的季节里,人们在公园常能闻到怡人的花香气味,这说明
。
(2)为了便于运输和使用,通常将石油气加压变成液态储存在钢瓶中。这一事实说明
。
(3)秸秆、煤炭、棉纱等,如果堆放不合理,空气不流通,时间长了就可能引起 。
(4)维生素C在酸性环境中比较稳定,受热时易被破坏,因此采用 的食用方法,才能充分利用黄瓜中丰富的维生素C。
(5)去年12月30日苏州降大雪,近千环卫职工冒着严寒深夜向桥梁的上下坡抛撒数吨工业用盐,请简述向积雪或冰面撒盐是为了
的缘故。
27、 有A、B、C、D四种元素,已知A元素的原子是自然界中质量最小的原子;B元素的常见单质占空气体积的21%;C元素的一种单质是天然物质里硬度最大的晶体;D元素以化合态广泛存在于石灰石等矿物中,它的阳离子带有两个单位的正电荷。请回答:
(1)A元素的单质的化学式是___________;D元素的阳离子的符号是__________;B元素所形成的常见单质的一种用途是_________________________________。
(2)由CB2转化为DCB3的化学方程式是_________________________________。
26、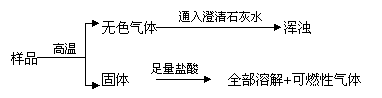 有一包粉末,可能含有碳酸钙、氧化铜、氧化铁、炭粉中的一种或几种,先作如下实验:
有一包粉末,可能含有碳酸钙、氧化铜、氧化铁、炭粉中的一种或几种,先作如下实验:
据此判断:粉末中一定含有_______;一定不含有_________;可能含有________,若要证明它的存在,可在样品中滴入________,此反应的化学方程式为
25.啤酒、红酒和白酒中都含有乙醇(C2H5OH),、饮酒后乙醇可进入人体血液中,科学实验表明,当乙醇在人体血液中的含量超过80mg/100mL血(每100mL血中含有80mg乙醇)时,便会影响人的驾车或操作机器的能力;已知饮用某啤酒l大杯(0.56L),会使血液中乙醇含量升高30mg/100mL血。回答下列问题:
(1)某位汽车驾驶员饮用了3大杯上述啤酒后,其体内每100mL血液中乙醇的含量(理论上)升高了 mg/100mL血。
(2)如该位驾驶员饮用上述量的啤酒后驾驶汽车, (选填“影响”或“不影响”)其驾车的能力。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com