
题目列表(包括答案和解析)
3. 右图是氯化铯晶体的晶胞结构示意图(晶胞是指晶体中最小的重复单元),其中黑球表示氯离子、白球表示铯离子。已知晶体中2个最近的铯离子的核间距离为a cm,氯化铯的摩尔质量为M g·mol-1,则理论上氯化铯晶体的密度为
右图是氯化铯晶体的晶胞结构示意图(晶胞是指晶体中最小的重复单元),其中黑球表示氯离子、白球表示铯离子。已知晶体中2个最近的铯离子的核间距离为a cm,氯化铯的摩尔质量为M g·mol-1,则理论上氯化铯晶体的密度为
A.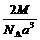 g·cm-3
B.
g·cm-3
B.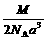 g·cm-3
g·cm-3
C.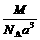 g·cm-3
D.
g·cm-3
D.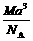 g·cm-3
g·cm-3
2.某同学利用中学化学教材中提供的数据或图表进行如下推理和判断,其中错误的是
A. 依据中和热的数据;推算一定量的H2SO4和NaOH的两种稀溶液反应放出的热量
B. 依据沸点的数据,判断将两种互溶的液态混合物用蒸馏方法分离开来的可能性
C. 依据相对分子质量,一定能判断组成和结构相似的物质熔沸点的高低
D.依据元素的原子结构,可以推知其在元素周期表中的位置
1.我国科学家为一个比头发丝还细的小分子恢复了磁性,由此创造了一项“世界第一”。实验时将一种名为“钴酞菁”的小分子搬上了“手术台”。这个“个头”仅为1.3纳米的小分子,其结构和性质与人体内的血红素及植物体内的叶绿素非常相似,在光电子器件、生物技术等方面具有广泛而重要的应用与研究价值。下列说法正确的是 ( )
A.“钴酞菁”的小分子具有胶体的性质
B.纳米材料可以应用于所有化工领域
C.现在纳米器件都是无所不能的胶体
D.此工作实现了利用局域的化学反应来改变和控制分子的物理性质
25.(8分)将KOH和Ca(OH)2的混合物1.3g全部溶于一定量的水中形成稀溶液,再缓缓通入足量的CO2气体,实验过程中可得到沉淀的最大质量为1.0g。试计算:
⑴ 原混合溶液中KOH的质量
⑵ 生成沉淀质量最大时,消耗CO2气体的体积最少为多少?(标准状况)
24.(8分)过氧乙酸(C2H4O3)是一种消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
 ① 2MnO4-+5H2O2+6H+
2Mn2++5O2十8H2O
① 2MnO4-+5H2O2+6H+
2Mn2++5O2十8H2O
 ② H2O2+2
② H2O2+2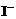 +2H+
I2+2H2O
+2H+
I2+2H2O
 ③ C2H4O3+2
③ C2H4O3+2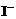 +2H+
CH3COOH+I2+H2O
+2H+
CH3COOH+I2+H2O
 ④ 2 S2O32-+I2
S4O62-+2I-
④ 2 S2O32-+I2
S4O62-+2I-
取20mL待测液,用硫酸使溶液酸化,再用浓度为1mol·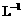 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为20mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。另取20 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为3 mol·
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为20mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。另取20 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为3 mol·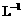 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为60mL。
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为60mL。
(1)已知过氧乙酸分子部分含有与H2O2相同的“结构”,则其结构简式为 。
(2)根据上述实验数据,可计算过氧乙酸物质的量浓度c0= _______________________。
(3)当加入的KI的质量 (填写选择序号)时,可不影响测定过氧乙酸的浓度c0。 (多选或少选均不给分)
A.少量需要准确称量 B.少量不需要准确称量 C. 过量需要准确称量 D. 过量不需要准确称量
23.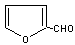
 (10分)已知:HCN的结构为
(10分)已知:HCN的结构为 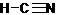 , R-CN
RCOOH,R-Cl+CN-
, R-CN
RCOOH,R-Cl+CN-
 R-CN+Cl-(R为烃基)。玉米芯、甘蔗渣等废物水解发酵后可制得糠醛 ,它是重要的化工原料,它在一定条件下可发生以下变化:
R-CN+Cl-(R为烃基)。玉米芯、甘蔗渣等废物水解发酵后可制得糠醛 ,它是重要的化工原料,它在一定条件下可发生以下变化:
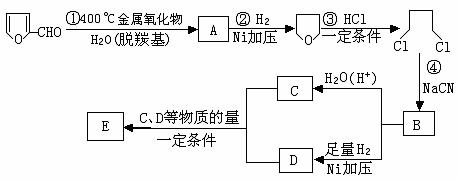
⑴写出反应类型:② ,④ 。
⑵写出反应③的化学方程式: ;
写出能证明糠醛中含有醛基的一个化学反应方程式
。
⑶若E为环状化合物,则其结构简式 。
⑷若E为高聚物,则其结构简式 。
22.(8分)在有机物分子中,常把连有4个不同原子或原子团的碳原子称为“手性碳原子”。含有手性碳原子的分子一般都具有某些光学活性。经测定某新合成的化合物A具有光学活性,其结构简式为:
 。若要在保持A分子中碳原子数不变的前提下,通过适当的反应使A失去光学活性,有两种方法:
。若要在保持A分子中碳原子数不变的前提下,通过适当的反应使A失去光学活性,有两种方法:
(1)有机反应类型: 反应,对应有机物的结构简式: ;
(2) 有机反应类型: 反应,对应有机物的结构简式: ;
21、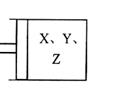 (10分)如右图所示,将6molX和3molY混合气体置于体积可变的等压容器中,在一定温度下发生如下反应:2X(g)+Y(g)
(10分)如右图所示,将6molX和3molY混合气体置于体积可变的等压容器中,在一定温度下发生如下反应:2X(g)+Y(g)  2z(g)。
2z(g)。
反应达到平衡状态A时,测得气体总物质的量为6.6mol。若X、Y、z的起始物质的量分别用a、b、c表示,回答下列问题:
(1)达平衡状态A时,Y的转化率为 ,在达到平衡状态A的容器中通人少量Y.体系中X的体积分数 (填“增大”或“减小”或“不变”)。
(2)若起始时a=3.2mol,且达到平衡后各气体的体积分数与平衡状态A相同,则起始
时b、c的取值分别为 。
(3)若要使反应开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状
态A相同,则起始时c的取值范围是 。
20.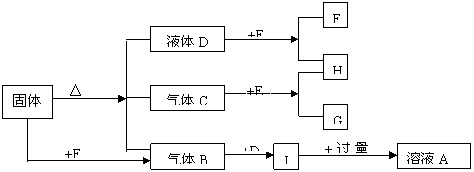 (12分)下图中A-G是化合物,H是一种无色气态单质,D常温下是一种无色液体,它们有如下转化关系:
(12分)下图中A-G是化合物,H是一种无色气态单质,D常温下是一种无色液体,它们有如下转化关系:
(1)写出A的名称: ;B的分子式: ;C结构式: ;
E电子式: ;
(2)C与E反应的化学方程式: ;
(3)A溶液与F浓溶液反应的离子方程式: 。
19.(10分)现有A、B、C、D四种短周期元素,A元素的原子半径是除稀有气体外半径最大的,B元素的原子最外层比次外层多3个电子,C元素是人体中质量分数最大的,D元素的一种核素质量数与质子数相等。请据此填空:
(1)A的原子结构示意图是 ;B2分子的电子式是 。
(2)C元素常见单质的化学式为 、 。
(3)C和D可形成电子数相同的两种粒子,该两种粒子反应后生成一种中性分子,反应的离子方程式是 。
(4)A与B形成的一种化合物中,A元素的质量分数为35.4%,该化合物的摩尔质量不超过70g/mol,则该化合物的化学式是 ,其中可能有的化学键为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com