
题目列表(包括答案和解析)
8.下列用来表示物质变化的化学用语中,正确的是( )
A.钢铁腐蚀时负极反应 Fe-3e-=Fe3+
 B.Na2SO3溶于硝酸 2H++SO
B.Na2SO3溶于硝酸 2H++SO = H2O+SO2↑
= H2O+SO2↑
C.铁粉和硫粉混合反应 2Fe+3S===Fe2S3
D.氯化铵溶液显酸性 NH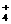 +H2O
+H2O 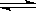 NH3·H2O+H+
NH3·H2O+H+
7.对于某些离子或气体的检验及结论一定正确的是( )
A.某气体通入品红溶液,溶液红色褪去,该气体一定是SO2
B.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
C.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO
D.向某瓶红棕色气体中,加入氢氧化钠溶液振荡后,得到无色溶液,一定是NO2
6.常温下,下列离子能与H+、Cl-、Fe3+在同一溶液中大量共存的是 ( )
A.Fe2+ B.ClO- C.I- D.HCO3-
11.(16分)咖啡酸(下式中的A)是某种抗氧化剂成分之一,A与FeCl3溶液反应显紫色。
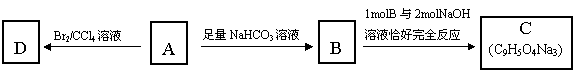
(1)咖啡酸中含氧官能团的名称为___________________________________________。
(2)咖啡酸可以发生的反应是____________________________________(填写序号)。
① 氧化反应 ② 加成反应 ③ 酯化反应 ④ 加聚反应 ⑤ 消去反应
(3)咖啡酸可看作1,3,4-三取代苯,其中两个相同的官能团位于邻位,取代基中不含支链。则咖啡酸的结构简式为_______________________________________。
(4)3.6 g咖啡酸与足量碳酸氢钠反应生成气体(标准状况)______________mL。
(5)蜂胶的主要活性成分为CPAE,分子式为C17H16O4,该物质在一定条件下可水解生成咖啡酸和一种醇,该醇为芳香醇,且分子结构中无甲基,则咖啡酸跟该芳香醇在一定条件下反应生成CPAE的化学方程式为__________________________________________________。
 12.(14分)某学生用胆矾制取氧化铜固体,并研究氧
12.(14分)某学生用胆矾制取氧化铜固体,并研究氧
化铜能否在在氯酸钾受分解实验中起催化作用。
实验步骤如下:
①称量a g胆矾固体放入烧杯中,加水制成溶液,
向其中滴加氢氧化钠溶液至沉淀完全;
②把步骤①中的溶液和沉淀转移至蒸发皿中,
加热至溶液中的沉淀全部变成黑色氧化铜为止;
③过滤、洗涤、干燥,称量所得固体质量为b g;
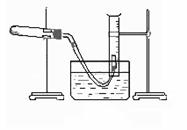
④取一定质量的上述氧化铜固体和一定质量的氯酸钾固体,混合均匀后加热,收集反应生成的氧气,如图所示。
请回答下列问题:
(1)上述各步操作中,需要用到玻璃棒的是(填写前面所述实验步骤的序号)
。
(2)由胆矾制备氧化铜的产率(实际产量与理论产量的百分比)为 ×100%。
(3)为保证Cu2+沉淀完全,步骤①中溶液的pH应大于10。简述pH试纸测定溶液pH
的操作: 。
(4)为证明氧化铜在氯酸钾的分解反应中起催化作用,在上述实验①~④后还应该进行
的实验操作是(按实验先后顺序填写字母序号) 。
a.过滤 b.烘干 c.溶解 d.洗涤 e.称量
(5)但有的同学认为,还必须另外再设计一个实验才能证明氧化铜在氯酸钾受热分解的
实验中起催化作用。你认为还应该进行的另一个实验是
。
10.(16分)A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。
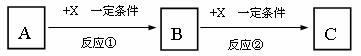
试回答:
(1)若X是强氧化性单质,则A不可能是________________。
a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为____________;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示)_________________________________________,检验此C溶液中金属元素价态的操作方法是____________________________。
(3)若A、B、C为含有金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为_____________,X的化学式可能为(写出不同类物质)_________或_________,反应①的离子方程式为____________________________或____________________________。
9.(14分)几种短周期元素的原子半径及某些化合价见下表:
|
元素代号 |
A |
B |
D |
E |
G |
H |
I |
J |
|
化合价 |
–1 |
–2 |
+4、–4 |
+4、–2 |
+5、–3 |
+3 |
+2 |
+1 |
|
原子半径/nm |
0.071 |
0.074 |
0.077 |
0.102 |
0.110 |
0.143 |
0.160 |
0.186 |
分析上表中有关数据,并结合已学过的知识,回答以下问题。涉及上述元素的答案,请用元素符号表示。
(1)E元素在周期表中位于 周期, 族;
(2)A、H、J对应的离子半径由大到小的顺序是(填写离子符号) ;
(3)A与J所形成化合物的晶体类型是 ,用电子式表示其形成过程 ;
(4)B与H所形成的化合物与J的最高价氧化物的水化物X的溶液发生反应的离子方程式为 ;D与B形成的某种化合物Y不仅能与X反应,还能与I的单质反应,则Y与I的单质反应的化学方程式为 。
8.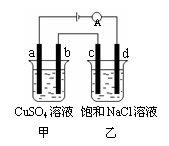 如图所示,a、b、c、d均为石墨电极,通电进行电解。下列说法正确的是
如图所示,a、b、c、d均为石墨电极,通电进行电解。下列说法正确的是
A.乙烧杯中d的电极反应为 2Cl––2e– Cl2↑
Cl2↑
B.a、c两极产生气体的物质的量相等
C.甲、乙两烧杯中溶液的pH均保持不变
D.乙烧杯中发生的反应为
2NaCl + 2H2O
 2NaOH + H2↑+ Cl2↑
2NaOH + H2↑+ Cl2↑
7.对于达到平衡的可逆反应:X + Y W + Z,其他条件不变时,增大压强,正、逆反应速率(U)变化的情况如图所示。下列对X、Y、W、Z四种物质状态的描述正确的是
W + Z,其他条件不变时,增大压强,正、逆反应速率(U)变化的情况如图所示。下列对X、Y、W、Z四种物质状态的描述正确的是
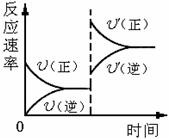
(A)W、Z均为气体,X、Y中只有一种为气体
(B)X、Y均为气体,W、Z中只有一种为气体
(C)X、Y或W、Z中均只有一种为气体
(D)X、Y均为气体,W、Z均为液体或固体
6.下列反应的离子方程式书写不正确的是
(A)硫酸铜水解:Cu2++2H2O Cu(OH)2+2H+
Cu(OH)2+2H+
(B)澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2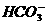 =CaCO3↓+
=CaCO3↓+ +2H2O
+2H2O
(C)氯化铝溶液加入过量的氨水:Al3++3NH3·H2O=A1(OH)3↓+3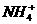
(D)NaHSO4溶液中滴加NaHCO3溶液:H++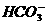 =H2O+CO2↑
=H2O+CO2↑
5.二氧化硫的催化氧化是放热反应。下列关于接触法制硫酸的叙述中正确的是 (A)为防止催化剂中毒,炉气在进入接触室之前需要净化
(B)为提高SO2的转化率,接触室内反应温度选定在400℃~500℃ (C)为防止污染大气,从吸收塔出来的尾气常用NaOH溶液吸收
(D)为提高SO3的吸收效率,用稀硫酸代替水吸收SO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com