
题目列表(包括答案和解析)
5、在强酸性溶液中能大量共存且溶液为无色透明的离子组是( )
A、Ca2+ Na+ NO3- SO42- B、Mg2+ Cl- Al3+ SO42-
C、K+ Cl- HCO3- NO3- D、Ca2+ Fe3+ Na+ NO3-
4、将4gNaOH分别加入100mL下列液体中(设密度均为1g•cm-3),溶液的导电能力变化不大的是( )
A、自来水 B、3.65%的稀盐酸 C、6%的稀醋酸 D、5.35%的氯化铵溶液
3、判断下列说法正确的是( )
A、离子化合物都是强电解质 B、其水溶液能导电的物质都是电解质
C、强电解质溶液的导电性一定比弱电解质溶液的导电性强
D、强电解质都是离子化合物,弱电解质都是共价化合物
2、下列化合物中,只有在水溶液中才能导电的电解质是( )
A、NaCl B、C2H5OH C、H2SO4 D、NaHCO3
1、核工业中常作快中子反应堆热交换剂的是( )
A、钠钾合金 B、铀汞合金 C、生水 D、镁
0.124g x2
x2=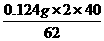 =0.16g
=0.16g
x=x1+x2=0.80g+0.16g=0.96g
氢氧化钠溶液的质量分数为:
NaOH%=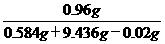 ×100%=9.6%
×100%=9.6%
答案:0.092g 9.6%
13.有一块表面被氧化成氧化钠的金属钠,质量为0.584g,放入9.436gH2O中,当反应结束时,在标准状况下生成氢气0.02g,此金属钠中有多少克钠在与水反应前被氧化?所得氢氧化钠溶液的质量分数是多少?
解析:设含钠的质量为m,其生成的氢氧化钠质量为x1,被氧化的钠的质量为y
2Na+2H2O 2NaOH+H2↑
2NaOH+H2↑
2×23 2×40 2
m x1 0.02g
m=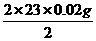 =0.46g
=0.46g
x1=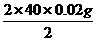 =0.80g
=0.80g
氧化钠的质量为:0.584g-0.46g=0.124g
4Na+O2 2Na2O
2Na2O
4×23 2×62
y 0.124g
y=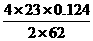 =0.092g
=0.092g
设氧化钠生成氢氧化钠的质量为x2
Na2O+H2O 2NaOH
2NaOH
62 2×40
12.把下列离子方程式改写成化学方程式。
(1)Ba2++SO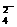
 BaSO4↓__________________________________;
BaSO4↓__________________________________;
(2)2H++CO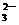
 CO2↑+H2O__________________________________;
CO2↑+H2O__________________________________;
(3)Fe2O3+6H+ 2Fe3++3H2O__________________________________;
2Fe3++3H2O__________________________________;
(4)Cl2+2OH- Cl-+ClO-+H2O__________________________________;
Cl-+ClO-+H2O__________________________________;
答案:(1)BaCl2+Na2SO4 BaSO4↓+2NaCl;
BaSO4↓+2NaCl;
(2)Na2CO3+H2SO4 Na2SO4+CO2↑+2H2O;
Na2SO4+CO2↑+2H2O;
(3)Fe2O3+6HCl 2FeCl3+3H2O;
2FeCl3+3H2O;
(4)Cl2+2NaOH NaCl+NaClO+H2O
NaCl+NaClO+H2O
(说明:以上各小题答案不唯一,其他合理答案也对)
11.写出下列离子方程式。
(1)钠投入到水中__________________________________;
(2)自来水厂将氯气溶解于水消毒________________________________;
(3)将氯气通入氢氧化钠溶液制漂白剂和消毒剂_________________________________;
(4)使用(3)中的漂白剂漂白衣服__________________________________;
(5)用废铁屑置换回收含重金属Ag+的废液中的银_______________________________;
(6)大理石像上洒上盐酸__________________________________。
答案:(1)2Na+2H2O 2Na++2OH-+H2↓
2Na++2OH-+H2↓
(2)Cl2+H2O H++Cl-+HClO
H++Cl-+HClO
(3)Cl2+2OH- Cl-+ClO-+H2O
Cl-+ClO-+H2O
(4)ClO-+H2O+CO2 HCO
HCO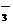 +HClO
+HClO
(5)Fe+2Ag+ Fe2++2Ag
Fe2++2Ag
(6)CaCO3+2H+ Ca2++CO2↑+H2O
Ca2++CO2↑+H2O
10.相同质量的钠、镁与过量的稀硫酸反应,在标准状况下产生氢气的质量比是________,若过量的相同质量的钠、镁与相同质量分数、相同质量的硫酸溶液反应,产生氢气最多的是________。
解析:反应时金属与产生的H2的关系是:①2Na-H2 ②Mg-H2,相同质量的钠、镁的物质的量比为24∶23,而每摩尔钠和镁产生氢气物质的量比为1∶2,所以产生氢气的质量比是(24×1)∶(23×2)=12∶23;过量的金属与一定量的酸反应,当硫酸中H+全部被钠和镁置换生成H2,即放出氢气的量相等。此时,镁的反应停止,而金属钠将继续和水反应,放出H2,所以钠放出的氢气最多。
答案:12∶23 钠
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com