
题目列表(包括答案和解析)
14.常温下,有甲、乙两份体积均为1 L,浓度均为0.1 mol·L-1的氨水,其pH为11。
①甲用蒸馏水稀释100倍后,溶液的pH将为a;②乙与等体积、浓度为0.2mol·L-1的HCl混合,在混合溶液中:n(NH4+)+n(H+)-n(OH-)=b mol 。a、b正确的答案组合是
A.9-11之间;0.1 B.9-11之间;0.2
C.12-13之间;0.2 D.13;0.1
13.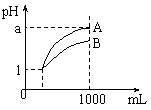 室温下,pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图,下列说法正确的是
室温下,pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图,下列说法正确的是
A.A、B两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液强;
C.若a = 4,则A是强酸,B是弱酸;
D.稀释后,a可能大于4。
12.可逆反应2SO2(g) + O2(g) ⇌ 2SO3 (g) 从正方向开始,并达到了平衡。此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是 ( )
A.新平衡体系中,SO2和O2物质的量之比仍为2∶1
B.平衡向正反应方向移动了,原因是正反应速率增大了,逆反应速率减小了。
C.新平衡体系与旧平衡体系比较,SO3的浓度肯定增大了
D.若所采取的措施是缩小容器的容积,则新平衡SO2和O2转化率之比和旧平衡中SO2和O2的转化率之比都是1∶1
11.在周期表主族元素中,甲元素与乙、丙、丁三元素相邻,甲、乙的原子序数之和等于丙的原子序数;这四种元素原子的最外层电子数之和为20。下列判断中,正确的是
A.原子半径:丙>乙>甲>丁
B.气态氢化物的稳定性:甲>丙
C.最高氧化物水化物的酸性:丁>甲
D.乙和甲或乙和丁所能形成的化合物都是有毒物质
10.常温下,在指定环境中,下列各组离子能够大量共存的是
A.
pH=1的溶液中;Na+、K+、SO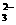 、MnO
、MnO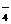
B.
pH=7的溶液中:Na+、Al3+、Cl-、SO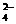
C.pH=0的溶液中Na+、K+、NO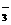 、ClO-
、ClO-
D.pH>12的溶液中:Na+、K+、SO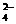 、AlO
、AlO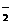
9.已知1个白磷分子由4个磷原子构成,白磷分子呈正四面体结构,4个磷原子位于正四面体的4个顶点。设NA为阿伏加德罗常数,下列说法正确的是
A.2mol甲基中含有14NA个电子
B.在标准状况下相同体积的C18O和16NO气体中含有相同的中子数
C.124g白磷中含有P-P键的数目是6NA
D.100℃时的纯水的pH=6,此时1mL纯水含有10-9NA个OH-
8.下列实验操作正确的是
A.配制100g10%的硫酸铜溶液时,称取10g硫酸铜晶体溶解于90g水中
B.测定硫酸铜晶体中结晶水含量时,须用小火缓慢加热,同时用玻璃棒轻轻搅拌硫酸铜晶体,防止晶体飞溅
C.为检验酸性溶液中的Cl-和SO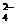 ,要先加硝酸银溶液,滤去沉淀后加硝酸钡溶液
,要先加硝酸银溶液,滤去沉淀后加硝酸钡溶液
D.配制一定物质的量浓度的硫酸溶液时,应将量取好的浓硫酸先放入烧杯中,然后加水稀释
7.下列有关比较中,大小顺序排列错误的是
A.热稳定性:PH3>H2S>HBr>NH3
B.物质的熔点:石英>食盐>冰>汞
C.结合质子的能力:CO32->CH3COO->SO42-
D.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
6. 下列有关物质的结构或性质的叙述错误的是
A. 由极性键形成的分子不一定是极性分子
B. 水是一种非常稳定的化合物,这是由于氢键所致
C. 石英、食盐、金属钠、干冰的熔点依次降低
D. 分子晶体中一定存在分子间作用力,可能有共价键
5.下列说法或表示法正确的是
A.若将等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(石墨)-→C(金刚石);△H= +119 kJ / mol ”可知,金刚石比石墨稳定
C.在稀溶液中: H++OH-=H2O;△H=-57.3 kJ / mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g) = 2H2O(l);△H = +285.8 kJ / mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com