
题目列表(包括答案和解析)
13.正常人胃液的pH在0.3-1.2之间,酸(一般以盐酸表示)多了,需要治疗.某些用以治疗胃酸过多的药物中含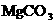 、
、 ,还有用酒石酸钠来治疗.这主要是由于
,还有用酒石酸钠来治疗.这主要是由于
A.对人体而言酒石酸是营养品 B.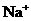 、
、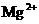 都是人体必需的元素
都是人体必需的元素
C.碳酸、酒石酸都不是强酸
D.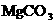 、
、 与胃酸作用生成
与胃酸作用生成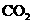 ,在服药后有喝汽水的舒服感
,在服药后有喝汽水的舒服感
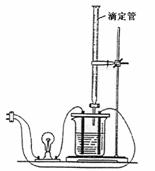 11.利用右图装做下面的实验:在烧杯里盛半杯乙溶液,
11.利用右图装做下面的实验:在烧杯里盛半杯乙溶液,
然后用滴定管向容器里滴入甲溶液。随着甲的滴入,
电灯渐渐变暗。滴到一定量时,电灯熄灭。继续滴入
甲溶液,电灯又会逐渐亮起来。下列各组溶液中
(甲在前,乙在后),能够产生上述现象的是( )
A.NH3·H2O、AgNO3
B.CH3COOH、NH3·H2O
C.NaOH、AlCl3
D.H2SO4、Ba(OH)2
12.常温下,将pH=1的硫酸溶液平均分成两等份,一份加入适量水,另一份加入与该硫酸溶液物质的量浓度相同的氢氧化钠溶液,两者pH都升高了1,则加入水和加入NaOH溶液的体积比约为 ( )
A.11:1 B.10:1 C.6:1 D.5:1
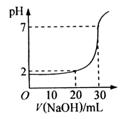
10.如图为10mL一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定的图示。依据图示,推出X和Y的物质的量浓度是 ( )
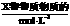 |
A |
B |
C |
 D D |
|
|
0.12 |
0.04 |
0.03 |
0.09 |
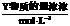 |
0.04 |
0.12 |
0.09 |
0.03 |
9.已知Cl2、Al2S3、CaC2、C2H5Br、CH3COOCH3等物质的均能与水发生反应,反应可视为各物质和水均分别离解成两部分,然后再两两重新组合,形成新的物质。下列化学反应符合这一特点的是 ( )

①ICl+H2O→HIO+HCl; ②CH3CCl+H2O→CH3 COH+HCl;
③CaC2+2H2O→Ca(OH)2+C2H2↑;④Mg3N2+6H2O→3Mg(OH)2+2NH3↑;
⑤SiCl4+4H2O→H4SiO4↓+4HCl↑。
A.只有①④⑤ B.只有②③⑤ C.只有①②③④ D.全部
8.常温下,盐酸与氨水混合,所得溶液pH=7,则此溶液中 ( )
A.[ ]<[
]<[ ] B.[
] B.[ ]=[
]=[ ]
]
C.[ ]>[
]>[ ] D.无法确定[
] D.无法确定[ ]与[
]与[ ]的关系
]的关系
7.下列方法能使电离平衡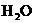
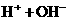 向右移动,且使溶液呈酸性的
向右移动,且使溶液呈酸性的
A.向水中加入少量硫酸氢钠固体 B.向水中加入少量硫酸铝固体
C.向水中加入少量碳酸钠固体
D.将水加热到100℃,使水的pH=6
6.用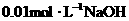 溶液完全中和pH=3的下列溶液各100mL需NaOH溶液体积最大的是
( )
溶液完全中和pH=3的下列溶液各100mL需NaOH溶液体积最大的是
( )
A.盐酸 B.硫酸 C.高氯酸 D.醋酸
5.健康人血液的pH总是维持在7.35-7.45之间,这是由于 ( )
A.人体内含有大量水分
B.血液中NaCl的含量保持恒定不变
C.人体排出的酸性物质与碱性物质部分溶解在血液中
D.血液中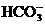 和
和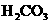 只允许在一定的比例范围
只允许在一定的比例范围
4. 把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) Ca2++2OH-下列说法正确的是 ( )
把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) Ca2++2OH-下列说法正确的是 ( )
A.恒温下向溶液中加CaO,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
3.为了更合理地表示溶液的酸碱性,科学家提出“酸度”(用AG表示)概念,
AG=lg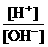 .下列叙述正确的是
( )
.下列叙述正确的是
( )
①任何温度下,水的AG等于0 ②溶液的AG越小,酸性越强
③常温下,0.1mol·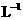 盐酸的AG=12 ④25℃时,某溶液的AG=-10,其pH=10
盐酸的AG=12 ④25℃时,某溶液的AG=-10,其pH=10
A.①③ B.②④ C.①② D.③④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com