
题目列表(包括答案和解析)
27.(8分)在一个固定体积的密闭容器中,向容器中充入2 mol A和1 mol B,发生如下反应:2A(g) + B(g)  3C(g) + D(s),反应达到平衡时C的浓度为1.2 mol/L。
3C(g) + D(s),反应达到平衡时C的浓度为1.2 mol/L。
(1)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为________(填“吸热”或“放热”)反应。
(2)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是_________(用序号填空)
①4 mol A+2 mol B ②3mol C+1 mol D+l mol B
③3 mol C+2 mol D ④1.6 mol A+0.8 mol B+0.6 mol C
(3)向容器中加入3 mol C和0.8 mo1 D,反应达到平衡时C的浓度仍为1.2 mol/L,则容器的容积V应大于_________L,小于________L。
(4)若设容器体积为1L,温度不变,反应从逆反应开始 (反应物只有C和D ),按不同的配比作为起始物质,达到平衡时,C的浓度仍为1.2mol/L,则D的起始物质的量应满足的条件是___________。
25.(8分)卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近。试回答下列问题:
 ⑴卤素互化物BrCl能发生下列反应
⑴卤素互化物BrCl能发生下列反应
H2O+BrCl===HBrO+HCl
KBr+BrCl===KCl+Br2
①写出KI与IBr反应的化学方程式______________。
②写出苯与(C6H6)与ICl发生取代反应生成一卤代物的化学方程式____________________________。
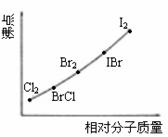
⑵右图是部分卤素单质和XX’型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是______________。
⑶试推测ICl的沸点所处的最小范围______________。
24.(10分)科学家用NaNO3和Na2O在一定条件下化合制得晶体A,A由钠离子和某阴离子B构成, 则:
(1)A的化学式为 , A 与Na3PO4比较,化学活泼性比Na3PO4 (填强或弱),阴离子B的空间立体结构形状最有可能是 ;
(2)A对CO2特别敏感,与CO2反应相当剧烈,生成两种常见的物质,该反应的化学方程式为: ;
(3)此外,科学家还制备了另一种钠盐D,其与A的组成元素完全相同,D中的阴离子与A中的阴离子表观形式相同(元素种类和原子个数均相同),但D中阴离子的结构中含有一个过氧键:-O-O- ,电导实验表明,同条件下其电导能力与NaCl相同,该阴离子的化学式为 ,其与水反应生成过氧化氢的离子方程式为 ,该反应 (填是或不是)氧化-还原反应
23.(10分)已知1-丙醇的沸点为97℃,乙酸的沸点为118℃。今有1-丙醇和乙酸的无水混合物,某同学拟通过蒸馏的方法分离开。
仪器和用品:铁架台(含铁圈)、酒精灯、火柴、石棉网、蒸馏烧瓶、单孔塞、温度计、尾接管、锥形瓶
方案Ⅰ:直接蒸馏
方案Ⅱ:按如下方法蒸馏
实验步骤:(1)连接好装置,检查装置的气密性。(2)将混合物加入到蒸馏烧瓶中,并加入适量的试剂a。(3)加热到97℃,并收集馏分。(4)冷却后,再向烧瓶中加入试剂b。(5)加热到118℃,并收集馏分。
请回答问题:
关于方案Ⅰ
① 如果直接蒸馏会有什么缺点?
关于方案Ⅱ
② 还缺什么仪器 ;蒸馏属于加热操作,所以操作过程中必须注意实验安全,请你列举两项实验安全措施: ; 。
③ 蒸馏时温度计位置在什么地方?
④ 下列实验需要用到温度计的是
A.中和热的测定 B.胆矾结晶水含量的测定 C.实验室制备乙烯 D.酯化反应
⑤ 试剂a最好选用 A.苯 B.CaO粉末 C.浓硫酸
加试剂a的作用
⑥试剂b最好选用 A.硫酸 B.硝酸 C.小苏打
22.(10分)某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
Ⅰ. 制取氧化铜 ①称取2 gCuSO4·5H2O研细后倒入烧杯,加10 mL蒸馏水溶解; ②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是_______________(填实验序号),步骤①、③中研磨固体所用仪器的名称是___________________;
(2)步骤③中洗涤沉淀的操作是__________________________________
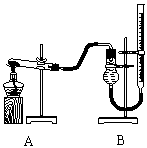 Ⅱ.证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较用右图装置进行实验,实验时均以生成25 mL气体为准,
Ⅱ.证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较用右图装置进行实验,实验时均以生成25 mL气体为准,
其它可能影响实验的因素均已忽略,相关数据见下表:
|
实验序号 |
KClO3质量 |
其它物质质量 |
待测数据 |
|
④ |
1.2 g |
无其他物质 |
|
|
⑤ |
1.2 g |
CuO 0.5
g |
|
|
⑥ |
1.2 g |
MnO2 0.5
g |
|
回答下列问题:
(3)上述实验中的“待测数据”指_____________;
(4)本实验装置图中量气装置B由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是___________(填“酸式”或“碱式”)滴定管;
(5)若要证明实验⑤中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞,___________________________________;
(6)为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a._______________________________,b.CuO的化学性质有没有改变。
21.(8分)证明KClO3中含有K、Cl、O三种元素的实验步骤及每一步的实验目的是
① ;
② ;
③ ;
④ 。
20.下列混合液中,各离子浓度的大小顺序正确的是
A.10ml.1mol/LNH4Cl溶液与5mL0.2mol/LNaOH溶液混合,
c(Na+)>c(C1-)>c(OH-)>c(H+)
B.10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合,
c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.10mL0.1mol/LCH3COOH溶液与5mL0.2moL/LNaOH溶液混合,
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.10mL0.5mol/LCH3COONa溶液与6mLlmoL/L盐酸混合,
c(Cl-)>c(Na+)>c(OH-)>c(H+)
第二卷 (非选择题共80分)
19. 分配系数是指弱电解质溶液中,溶质某种型体浓度与溶质型体总浓度的比值。分配曲线是指弱电解质溶液平衡状态时,每种型体浓度的分配系数与pH之间的关系曲线。对于CH3COOH总浓度c,它只有两种型体,平衡浓度分别为c(CH3COOH)、c(CH3COO-),则c= c(CH3COOH)+c(CH3COO-),设CH3COOH所占分配系数为δ1,CH3COO-所占分配系数为δ0,它们与pH的关系如图所示。下列有关说法正确的是
分配系数是指弱电解质溶液中,溶质某种型体浓度与溶质型体总浓度的比值。分配曲线是指弱电解质溶液平衡状态时,每种型体浓度的分配系数与pH之间的关系曲线。对于CH3COOH总浓度c,它只有两种型体,平衡浓度分别为c(CH3COOH)、c(CH3COO-),则c= c(CH3COOH)+c(CH3COO-),设CH3COOH所占分配系数为δ1,CH3COO-所占分配系数为δ0,它们与pH的关系如图所示。下列有关说法正确的是
A、由曲线可知在PH为1~7时,一定有δ1+δ0=1
B、c mol/L的CH3COOH溶液与c mol/LCH3COONa溶液等体积混合溶液显碱性
C、向CH3COOH溶液中不断滴加氢氧化钠溶液,
若c(CH3COO-) >c(Na+) >c(H+)> c(OH-)则δ1一定大于δ0
D、在cmol/L的H2C2O4(草酸)溶液中,一定满足=c(H2C2O4)+ c(C2O42-)=c
18.根据下列有关图象,说法不正确的是

A、由图象Ⅰ知,该反应在T1、T3处达到平衡,且该反应的△H<0
B、由图象Ⅱ知,该反应在t5阶段NH3体积分数最大
C、图象Ⅲ是在10L容器中850℃时反应,由图知,到4min时,反应放出51.6kJ的热量
D、由图象Ⅳ知,相同条件下起始时投入0.3mol/LX、0.1mol/LY和0.4mol/LZ反应,达到平衡后,Z的浓度为0.4mol/L
17.镓是1871年俄国化学家门捷列夫在编制元素周期表时曾预言的“类铝”元素。镓的原子序数为31,属ⅢA族。镓的熔点为29.78℃,沸点高达2403℃。镓有过冷现象(即冷至熔点下不凝固),它可过冷到-120℃。由此判断下列有关镓的性质及其用途的叙述不正确的是
A.镓是制造高温温度计的上佳材料 B. 镓能溶于强酸和强碱中
C.镓与锌、锡、铟等金属制成的合金,可用在自动救火的水龙头中
D.近年来镓成为电子工业的新宠,其主要用途是制造半导体材料,被誉为“半导体材料的新粮食”,这是利用了镓的导电性介于导体和绝缘体之间的性质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com