
题目列表(包括答案和解析)
17.现有含NaCl、Na2SO4、NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、NO3-的相互分离。相应的实验过程可用下图表示:
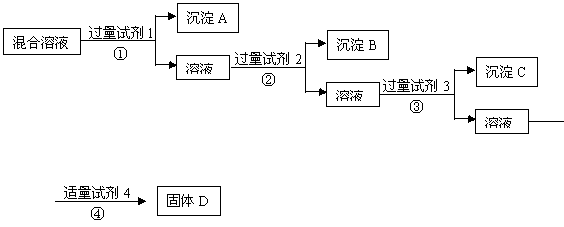
(1) 写出上述实验过程中所用试剂的名称:
试剂1___________试剂2_____________试剂4________________
(2)恰当地控制试剂4的加入量的方法是_________________________________
(3)加入过量试剂3的目的是_______________________________
(4)在加入试剂4后,获得固体D的实验操作④是___________(填操作名称)
16.某无色溶液,由Na+、Ba2+、Al3+、AlO2-、Fe3+、CO32-、SO42-中的若干种组成。取适量该溶液进行如下实验:① 加入过量盐酸,有气体生成;② 在①所得的溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;③ 在②所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。原溶液中一定存在的离子是
A.Al3+、Fe3+、SO42- B.Na+、AlO2-、CO32-
C.Na+、AlO2-、SO42-、CO32- D.Na+、Ba2+、AlO2-
第Ⅱ卷 (非选择题 共86分)
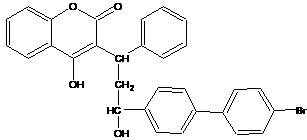
15.溴敌隆是一种理想的杀鼠剂,其结构简式如右图所示。溴敌隆在碱性条件下水解,再经酸化,其产物的化学式为C30H25BrO5。下列说法正确的是
A.溴敌隆的化学式为C30H24BrO4
B.在碱性条件下水解时,1mol溴敌隆将消耗4molNaOH
C.溴敌隆经水解,酸化后的产物(C30H25BrO5)1mol与足量浓溴水反应,消耗Br2的物质的量为3mol
D.1mol溴敌隆最多可与12molH2发生加成反应
14.接触法制硫酸通常在400-500℃、常压和催化剂的作用下,用SO2与过量的O2反应生成SO3。 2SO2(g)
+ O2(g)  2SO3(g) ;△H < O
2SO3(g) ;△H < O
在上述条件下,SO2的转化率约为90%。但是部分发达国家采用高压条件SO3,采取加压措施的目的是
A.发达国家电能过量,以此消耗大量能源
B.高压将使平衡向正反应方向移动,有利于进一步提高SO2的转化率
C.加压可使SO2全部转化为SO3,消除SO2对空气的污染
 D.高压有利于加快反应速率,可以提高生产效率
D.高压有利于加快反应速率,可以提高生产效率
13.镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越来越成为人们研制绿色原电池的关注焦点。其中一种镁原电池的反应为:
x Mg + Mo3S4 
 MgxMo3S4
MgxMo3S4
在镁原电池放电时,下列说法错误的是
A.Mo3S4发生氧化反应
B.正极反应为:Mo3S4 + 2xe- = Mo3S42x-
C.Mg2+向正极迁移
D.负极反应为:xMg - 2xe- = xMg2+
12.下列混合溶液中,各离子浓度的大小顺序正确的是
A.10mL0.1mol/LNH3·H2O溶液与10mL0.1mol/LHCl溶液混合:
c(Cl-) > c(NH4+) > c(OH-) > c(H+)
B.10mL0.1mol/LNH4Cl溶液与5mL0.2mol/LNaOH溶液混合:
c(Na+) = c(Cl-) > c(OH-) > c(H+)
C.10mL0.1mol/LCH3COOH溶液与5mL0.2mol/LNaOH溶液混合:
c(Na+) > C(CH3COO-) > c(OH-) > c(H+)
D.10mL0.5mol/LCH3COONa溶液与6mL1mol/LHCl溶液混合
c(Cl-) > c(Na+) > c(OH-) > c(H+)。
11.右图是10mLpH均为2的盐酸和醋酸分别与足量的碳酸钙反应
一段时间后,所观察到的实验现象(反应过程中产生的气体收集
在试管上部的气球中)。下列说法正确的是
A.甲试管中盛放的是盐酸溶液
B.甲试管中盛放的是醋酸溶液
C.图中所示的反应瞬间,甲试管中溶液的pH小于乙试管中溶液的pH
D.图中所示的反应瞬间,甲试管中溶液的pH大于乙试管中溶液的pH
10.下列反应的离子方程式正确的是
A.Cu和稀硝酸反应:3Cu + 8H+ + 2NO3-  3Cu2+ + 2NO↑+
4H2O
3Cu2+ + 2NO↑+
4H2O
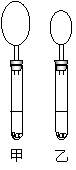 B.氢氧化镁与稀硫酸反应:H+ + OH- = H2O
B.氢氧化镁与稀硫酸反应:H+ + OH- = H2O
C.Ca(HCO3)2溶液与过量的NaOH溶液反应:
Ca2+ + 2HCO3- +2OH- = CaCO3↓+ CO32- + 2H2O
D.等物质的量浓度、等体积的NH4HCO3溶液与NaOH溶液相混合:
NH4+ + HCO3- + 2OH- = NH3·H2O + CO32- + H2O
9.阿佛加德罗常数约为6.02×1023 mol-1下列说法中正确的是
A.25℃时,纯水中含有的H+数为1×10-7×6.02×1023
B.Na与H2O反应生成1.12LH2(标准状况),反应中转移的电子数为0.1×6.02×1023
C.100mL0.2mol/L的Fe2(SO4)3溶液中,含有的Fe3+数为0.1×0.2×6.02×1023
D.46gN2O4气体中所含有的原子数为3×6.02×1023
8.下列对有关化学反应过程或实验现象的解释中,正确的是
A.Cl2的水溶液可以导电,说明Cl2是电解质
B.在高温条件下,C能置换出SiO2中的Si,说明C的氧化性强于Si
C.向淀粉碘化钾的溶液中加入氯水,溶液变为蓝色,说明Cl2的氧化性强于I2
D.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后,溶液褪色,说明BaCl2溶液有酸性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com