
题目列表(包括答案和解析)
18、下列各组离子在指定的环境中能大量存在的是
A、在pH=1的无色溶液中:SO42-、Cu2+、Na+、Cl-
B、在能使石蕊试纸变蓝色的溶液中:Na+、K+、S2-、CO32-
|
D、由水电离出的[H+]=1×10-12mol/L的溶液中:K+、Na+、Cl-、HCO3-
17、现有下列短周期元素性质的数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径 |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
0.82 |
|
最高化合价 最低化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
|
-2 |
|
|
-3 |
-1 |
|
-3 |
|
下列说法正确的是:
A.元素原子序数④大于⑦ B.②、③号元素处于同一周期
C.⑤号元素最高价氧化物的水化物酸性最强 D.⑧号元素是金属元素
16、常温离子液体(又称常温熔融盐),是当前化学研究的热点和前沿。1914年报道的第一种离子液体硝酸乙基铵((C2H5NH3)NO3)的熔点为12℃。已知C2H5NH2的化学性质与NH3相似,下列有关硝酸乙基铵的说法正确的是
A.该离子液体可以作为电池的电解质 B.硝酸乙基铵水溶液呈碱性
C.(C2H5NH3)NO3能与NaOH反应产生NH3
D.硝酸乙基铵水解的离子方程式或表示为:C2H5NH3++H2O=C2H5NH2+H3O+
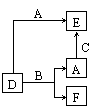
15、A、B、C分别是中学常见的单质。D、E、F是常见的三种氧化物,
其中E为有毒气体,且有如图所示转化关系。下列说法中不正确的是
A、若A是非金属,则B一定为金属 B、单质B肯定是氧化剂
C、A、B、C中一定有一种是氧元素的单质 D、D、E中一定都含有A元素
14、在101KPa时,1mol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。已知C(石墨)、H2和CO的燃烧热分别为393.5kJ/mol、285.8kJ/mol和282.8kJ/mol。现有H2和CO组成的混合气体56.0L(标准状况),经充分燃烧后,放出总热量为710.0kJ,并生成液态水。下列热化学方程式或描述中,正确的是
A、2CO(g) + O2(g) = 2CO2(g); △H= +282.8kJ/mol
B、2H2(g) + O2(g) = 2H2O(g); △H= -571.6kJ/mol
 C、C(石墨,s)
+ 1/2O2(g) = CO(g); △H= -110.7kJ/mol
C、C(石墨,s)
+ 1/2O2(g) = CO(g); △H= -110.7kJ/mol
D、燃烧前混合气体中,H2的体积分数为40%
13、NA表示阿佛加德罗常数。下列说法中正确的是
A、200mL1mol/LFe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是NA
B、在常温常压下,0.1mol铁与0.1molCl2充分反应,转移的电子数约为0.3NA
C、标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.5NA
D、S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
12、下列反应的离子方程式中,正确的是
|
B、用碳棒作电极电解硫酸铜溶液: 2Cu2+ + 2H2O ==== 2Cu + O2↑+ 4H+
C、将SO2通入次氯酸钙溶液中:Ca2+ + 2ClO- + SO2 + H2O = 2HClO + CaSO3↓
D、向Ba(OH)2溶液中加入过量的NaHSO4溶液:Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓+ 2H2O
11、类推的思维方法在化学学习与研究中常会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中,正确的是

 A、由2Cu
+ O2 == 2CuO可推出同族的硫也有Cu + S == CuS
A、由2Cu
+ O2 == 2CuO可推出同族的硫也有Cu + S == CuS
B、Fe3O4可表示为FeO·Fe2O3,则Pb3O4可表示为PbO·Pb2O3
C、Mg能在CO2中燃烧,所以Na也能在CO2中燃烧
D、CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应只生成Na2SO3和O2
22.(12分)重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:
6FeO·Cr2O3 +
24NaOH +7KClO3 12Na2CrO4 + 3Fe2O3 +7KCl + 12H2O,
12Na2CrO4 + 3Fe2O3 +7KCl + 12H2O,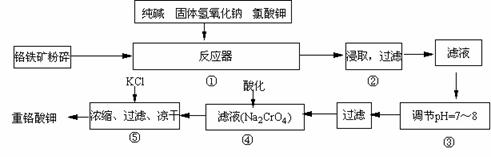
试回答下列问题
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出二氧化硅、氧化铝分别与碳酸钠反应的化学方程式:
; 。
(2)NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式: 。
(3)操作③的目的是什么,用简要的文字和化学方程式说明: 。
(4)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:
。
(5)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①判断达到滴定终点的依据是: ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品的中重铬酸钾的纯度(设整个过程中其它杂质不参与反应) 。
21.(12分)过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:
Ⅰ、二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是 。
A.苯与B3N3H6互为等电子体
B.甲醛、苯分子中碳原子均采用sp2杂化
 C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键
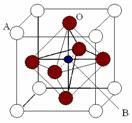
Ⅱ、2007年诺贝尔物理学奖为法国科学家阿尔贝·费尔和德国科学家彼得·格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就。某钙钛型复合氧化物(如右图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。
⑴用A、B、O表示这类特殊晶体的化学式: 。
⑵已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3, (x < 0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为: 。(用含x的代数式表示)
⑶Mn的核外电子排布式为: 。
 ⑷下列有关说法正确的是
。
⑷下列有关说法正确的是
。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.锰的电负性为1.59 ,Cr的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如右图:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com