
题目列表(包括答案和解析)
25.(10分)在真空密闭容器内加入a mol PH4I固体,在一定温度下发生如下反应:
PH4I(s)  PH3(g)+HI(g) 4PH3(g)
PH3(g)+HI(g) 4PH3(g)  P4(g)+6H2(g) 2HI(g)
P4(g)+6H2(g) 2HI(g)  H2(g)+I2(g)
H2(g)+I2(g)
以上三反应建立平衡后,测得HI为b mol,I2(g)为c mol,H2为dmol。求:(注:(1)、(2)小问用含a、b、c、d的代数式表示)
(1) 平衡时,PH4I的分解率
(2) 平衡后容器内PH3的物质的量
(3)a、b、c、d之间应满足:a > (填含b、c的代数式),b > (填含c、d的代数式)
24.(8分)某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g。
请回答以下问题:
⑴ 该结晶水合物中含有的两种阳离子是________和________,阴离子是_________。
⑵ 试通过计算确定该结晶水合物的化学式。
23.(8分)有两份溶液,其中所含溶质相同,设其摩尔质量为Mg/mol。
根据下表信息,回答有关问题:
|
|
溶质的质量分数 |
溶液的密度(g·cm-3) |
|
第一份溶液 |
ω1 |
ρ1 |
|
第二份溶液 |
ω2 |
ρ2 |
⑴第一份溶液中,溶质的物质的量浓度为 。
⑵取等质量两份溶液混合,则所得混合液中溶质的质量分数ω3= 。
⑶若有ω1>ω2,取等体积的两份溶液混合,设所得混合液中溶质的质量分数为ω4,试比较ω3、ω4的相对大小? 。
22.(8分)生活饮用水水质的标准主要有:色度、浑浊度、pH、细菌总数、嗅和味等。目前城市自来水处理过程中所使用的主要试剂仍是Cl2(消毒剂)和Al2(SO4)3(沉降剂),但由于种种原因,用这两种物质处理水质,总有缺陷。有资料报道:NaFeO4是一种强氧化剂,可作为一种新型净水剂,在反应中被还原为Fe3+,因此使用该物质可代替Cl2和Al2(SO4)3。
⑴配平工业制备铁酸钠的化学方程式:
Fe2O3+NaNO3+NaOH--Na2FeO4+NaNO2+H2O
⑵以上反应中,氧化剂为 (填编号)。
a.Fe2O3 b.NaNO3 c.NaOH d.Na2FeO4 e.NaNO2
⑶当反应物中含有1.4mol Na+,且上述反应恰好完全进行时,电子转移总数为 NA。
⑷据上海一具有一流生产工艺的自来水厂的科研人员介绍,目前仍不宜推广使用Na2FeO4,你认为其可能的主要原因是 (填编号)。
a.Na2FeO4是强氧化剂,作为消毒剂不合格
b.Na2FeO4被还原为Fe3+,Fe3+水解要形成胶体
c.Na2FeO4被还原为Fe3+,Fe3+在水中呈黄色,影响水质的色度
d.Na2FeO4被还原为Fe3+,Fe3+水解呈酸性,使pH略降低
21.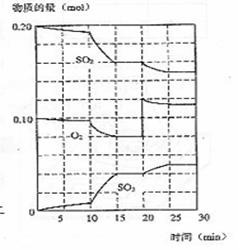 (12分)在一定条件下,二氧化硫和氧气发生如 下反应:
(12分)在一定条件下,二氧化硫和氧气发生如 下反应:
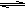 2SO2(g)+ O2
(g) 2SO3(g);△H﹤0
2SO2(g)+ O2
(g) 2SO3(g);△H﹤0
(1)降低温度,二氧化硫转化率 ,化学反应速度 (以上均填增大、减小或不变)
(2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 。
(3)据图判断,反应进行至20min时,曲线发生变化的原因是(用文字表达)
10min到15min的曲线变化的原因可能是(填写编号) 。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
20.(10分)如图Ⅰ,在恒压密闭容器M中加入2 mol A和2 mol B,起始时容器体积为V L,发生如下反应并达到化学平衡状态:
2 A(?)+B(?) x C(g);ΔH<0
x C(g);ΔH<0
平衡时A、B、C的物质的量之比为1∶3∶4,C的物质的量为 y mol。

⑴根据题中数据计算,x =_________、y =_________;
⑵如图Ⅱ,在体积为V L的恒容密闭容器N中发生上述反应(其它条件相同),测得反应过程中气体的平均相对分子质量随时间的变化如图Ⅲ(t0时达平衡),平衡时容器中C的物质的量为z mol。由于反应物A、B的状态未知,则z和y的大小也不确定,请在下表中填入A、B的状态与z、y的大小之间的关系(仿照情形①、可不填满):
|
可能的情形 |
A、B是否为气态 |
z与y的大小关系 |
M(B)与M(C)的大小关系 (M表示摩尔质量) |
|
|
A |
B |
|||
|
① |
是 |
不是 |
z = y |
前面的结论与此无关 |
|
② |
|
|
|
|
|
③ |
|
|
|
|
1.2 mol·L-1,则容器的容积V应大于_________L,小于________L。
19.(12分)在一个固定体积的密闭容器中,向容器中充入2 mol A和1 mol
B,发生如下反应:2A(g) + B(g) 3C(g)
+ D(s),反应达到平衡时C的浓度为1.2 mol·L-1。
3C(g)
+ D(s),反应达到平衡时C的浓度为1.2 mol·L-1。
(1)若使容器温度升高,平衡时混合气体的平均相对分子质量减小,则正反应为________(填“吸热”或“放热”)反应。
(2)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol·L-1的是_________(用序号填空)
① 4 mol A+2 mol B ② 3mol C+1 mol D+l mol B
③ 3 mol C+2 mol D ④ 1.6 mol A+0.8 mol B+0.6 mol C
(3)某温度下,向容器中加入3 mol C和0.8 mo1 D,反应达到平衡时C的浓度仍为
18.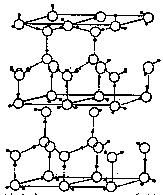 (10分)水分子间存在一种叫“氢键”的作用(介于范德华力与化学键之间)彼此结合而形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键相互连接成庞大的分子晶体,其结构示意图如图所示
(10分)水分子间存在一种叫“氢键”的作用(介于范德华力与化学键之间)彼此结合而形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键相互连接成庞大的分子晶体,其结构示意图如图所示
⑴1 mol冰中有 mol“氢键”
⑵水分子可电离生成两种含有相同电子数的微粒,其电离方程式为: 。
⑶在冰的结构中,每个水分子与相邻的4个水分子以氢键相连接。在冰晶体中除氢键外,还存在范德华力(11kJ•mol-1)。已知冰的升华热是51 kJ•mol-1,则冰晶体中氢键的能量是 kJ•mol-1
⑷用x、y、z分别表示H2O、H2S、H2Se的沸点(℃),则x、y、z的大小关系是 ,其判断依据是_______________________________。
17.(8分)现有A、B、C、D、E五种原子序数依次增大的短周期元素。已知:A、B两种元素的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2;在元素周期表中,C是E的邻族元素;D和E的原子序数之和为30;它们两两形成的化合物有甲、乙、丙、丁四种,这四种化合物中原子个数比如下表:
|
|
甲 |
乙 |
丙 |
丁 |
|
化合物中各元素原子个数比 |
A∶C = 1∶1 |
B∶A = 1∶2 |
D∶E = 1∶3 |
B∶E = 1∶4 |
回答下列问题:
⑴甲分子的电子式为 ;丁分子的空间构型为 。
⑵已知:乙分子中所有原子共平面,则实验室制取乙的化学方程式为
。
⑶丙的水溶液加热蒸干再灼烧,最后所得固体的成分是 (写化学式)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com