
题目列表(包括答案和解析)
3.关于工业生产的下列叙述中,不正确的是
A.工业生产硫酸时,使用热交换器可以充分利用反应中所放出的热量
B.工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的
C.工业上用离子交换膜法电解饱和食盐水制烧碱
D.工业上采用电解熔融氯化铝的方法制取金属铝
2.下列叙述不正确的是
A.原子晶体中原子间平均距离越小,熔、沸点越高
B.在水溶液中能电离出自由移动的离子的晶体不一定是离子晶体
C.SnH4 、GeH4、SiH4、CH4四种物质的熔点依次降低
D.水加热到很高的温度都难以分解,是因为水分子之间存在着氢键
1.俄罗斯杜布纳核联合研究所和美国劳伦斯利弗莫尔国家实验室的科学家在2004年2月的美国《物理评论C》杂志上发表文章宣布, 他们新合成了元素周期表上的第115号和第113号元素。科学家在利用回旋加速器进行的实验中,用具有20个质子的钙元素的同位素反复轰击含95个质子的镅元素,结果4次成功制成4个第115号元素的原子。这4个原子在生成数微秒后衰变成第113号元素。前者的一种核素为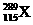 。下列有关叙述正确的是
。下列有关叙述正确的是
A.115号元素衰变成113号元素是化学变化
B.核素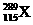 中中子数与质子数之差为174
中中子数与质子数之差为174
C.113号元素最高正价应为+3
D.115号与113号元素的原子质量比为115∶113
 21A .《 物质结构与性质 》( 12 分)
21A .《 物质结构与性质 》( 12 分)
铜合金是人类使用最早的金属材料。铜在化合物中的常见化合价有+ l 、 + 2 等,故能形成多种铜的化合物。
( l )基态 Cu 原子的电子排布式是 ;
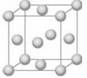
铜晶体晶胞如图所示,该晶胞实际拥有 个铜原子;
( 2 ) ①
某+ l 价铜的配离子为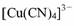 ,与配体互为等电子体的一种微粒是
,与配体互为等电子体的一种微粒是
(写化学式)。
②许多+l价铜的配合物溶液能吸收CO和烯烃(如C2H4、CH3CH= CH 2等), CH3CH= CH 2分子中c 子采取的杂化方式有
( 3 )在硫酸铜溶液中逐滴滴加氨水至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液。写出此蓝色沉淀溶解的离子方程式: ;
根据价层电子对互斥模型,预测SO42一的空间构型为
21B . ( (实验化学) ) ( 12 分)氢氧化钠固体常因吸收空气中的二氧化碳而变质。某研究性学习小组为探究氢氧化钠固体样品中的碳酸钠含量,设计了多种实验方案,请结合以下方案回答有关问题:
方案一:称取一定量的氢氧化钠样品mlg ,加水溶解后,逐滴加入沉淀剂至不再产生沉淀为止。将沉淀过滤、洗涤、烘干、称量,质量为 m : g 。沉淀剂使用氢氧化钡溶液而不用氢氧化钙溶液,结果将具有更高的精确度,原因是
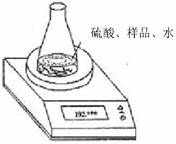 方案二:利用右图装置测定氢氧化钠样品中 Na2CO3的含量。计算Na2CO3质量分数时,必需的数据是
方案二:利用右图装置测定氢氧化钠样品中 Na2CO3的含量。计算Na2CO3质量分数时,必需的数据是
方案三:操作流程如下:
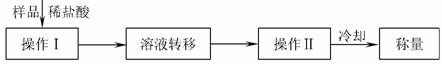
需直接测定的数据是 ;在转移溶液时,如溶液转移不完全,则Na2CO3质量分数的测定结果 (填“偏大”、“偏小”或“不变”)。
20. ( 7
分)臭氧可用于净化空气,漂白饮用水,杀菌,处理工业废物和作为漂白剂。但臭氧能刺激粘液膜,空气中臭氧的体积分数超过0.1 PPm ( PPm 表示百力分之一)对人体是不安全的。臭氧能与碘化钾溶液反应: 为测定大气中臭氧的含量,进行如下操作: ①
将标准状况下 33 . 6L的空气试样缓缓通入KI溶液,使之完全反应; ②在所得溶液中用 0 . 01 mol / L 的 Na2S2O3溶液 60 . 00mL 恰好与之完全反应。(反应方程式为:
为测定大气中臭氧的含量,进行如下操作: ①
将标准状况下 33 . 6L的空气试样缓缓通入KI溶液,使之完全反应; ②在所得溶液中用 0 . 01 mol / L 的 Na2S2O3溶液 60 . 00mL 恰好与之完全反应。(反应方程式为: 设反应过程中溶液的体积变化忽略不 计)
设反应过程中溶液的体积变化忽略不 计)
( l )试通过计算说明该空气试样中臭氧的体积分数对人体是否安全?
( 2 )取步骤 ① 所得溶液的1 / 50 ,欲将其中所含 KOH 完全中和,需 0 . 0012 mol / L 的盐酸体积是多少毫升?
原题:超细硅酸铝具有极好的悬浮性和纯白外观,与颜料配合能明显地改进涂料的白度。其样品化学式可表示为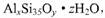 企业标准规定超细硅酸铝中含水量7%一10%为优良级。某化学兴趣小组为测定该样品的组成,按如下步骤处理:步骤一:准确称取 9 . 936g 超细硅酸铝样品,充分加热至不再分解为止,冷却、称量,得固体9.216g 。步骤二:另准确称取 9 .
936g 超细硅酸铝样品,加足量 4 mol / L 盐酸 150 mL ,充分反应后,过滤,洗涤,烘干得SiO2固体 8 . 400g
企业标准规定超细硅酸铝中含水量7%一10%为优良级。某化学兴趣小组为测定该样品的组成,按如下步骤处理:步骤一:准确称取 9 . 936g 超细硅酸铝样品,充分加热至不再分解为止,冷却、称量,得固体9.216g 。步骤二:另准确称取 9 .
936g 超细硅酸铝样品,加足量 4 mol / L 盐酸 150 mL ,充分反应后,过滤,洗涤,烘干得SiO2固体 8 . 400g
( l )计算该超细硅酸铝样品是否为优良级。
( 2 )求该样品的化学式。
11.梭酸梭基中轻基被氯原子取代的衍生物叫做酞氯。酞氯可以与醇反应生成醋,例如:
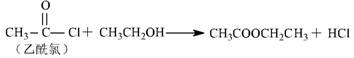
试回答下列问题:
( l )上述转化( ① 一 ⑤ )中,属于取代反应的有 (填序号,下同);属于氧化反应的有 ;属于加成反应的有 ( 2 )试剂 A 的结构简式为

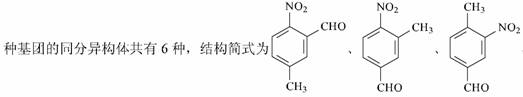
、 、 、
( 4 )写出下列化学方程式
反应⑤
中间体 B 在盐酸作用下发生水解
19. ( 13 分)氯霉素及其衍生物氯霉素棕桐酸酯是广普抑菌抗生素。成氯霉素及其衍生物氯霉素棕桐酸酯的合成路径。
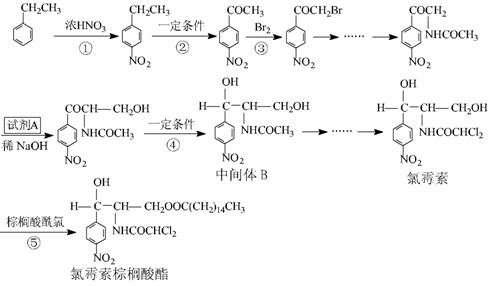
已知: 1 .在稀碱催化下,一些含羰基的化合物能发生如下反应:

18. ( 8 分)近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
( l )有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下: ( I )将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。(III)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用。
① 写出步骤(I)反应的化学方程式:
② 写出步骤(III)反应的离子方程式:
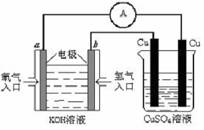
( 2)还有学者提出利用 Fe 2十、Fe3十等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率。

① 该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X 溶液可以是

A.碘的淀粉溶液 B . 酸性高锰酸钾溶液C .氢氧化钠溶液 D .氯化钡溶液
② 若上述实验是在标准状况下进行的,欲测定转化器中SO2氧化成SO42一的转化率,已知气体流速,还需测定的数据是
142. 9 kJ 热量。则H2燃烧的热化学方程式为
 (2)氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行右图所示实验:
① 氢氧燃料电池中,正极的电极反应式为
(2)氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行右图所示实验:
① 氢氧燃料电池中,正极的电极反应式为
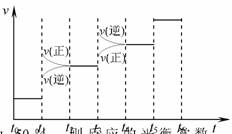 ②右图装置中,某一铜电极的质量减轻 3 . 29 ,则 a 极上消耗的O2在标准状况下的体积为
L
( 3 )氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
②右图装置中,某一铜电极的质量减轻 3 . 29 ,则 a 极上消耗的O2在标准状况下的体积为
L
( 3 )氢气是合成氨的重要原料,合成氨反应的热化学方程式如下: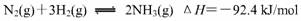 ① 当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示。图中tl 时引起平衡移动的条件可能是
① 当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示。图中tl 时引起平衡移动的条件可能是
其中表示平衡混合物中NH3的含量最高的一段时间是
②温度为T℃时,将2amolH2和amolN2放入0 . 5L密闭容器中,充分反应后测得N2的转化率为50﹪。则反应的平衡常数为
17. ( 12 分)氢气是一种新型的绿色能源,又是一种重要的化工原料。
(l)氢气燃烧热值高。实验测得,在常温常压下,1gH2完全燃烧生成液态水,放出
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com