
题目列表(包括答案和解析)
[提问]1.非金属元素数目?在周期表中所处区域?与周期序数的关系?
回答:
1.22种非金属元素,有6种是稀有气体;除H外均处于周期表右上方;除第一周期外,每周期非金属元素数目=8-周期序数。
29.(15分)实验室可用下列实验装置测定FeO和Fe2O3固体混合物中Fe2O3的质量(图中夹持装置已略去)。
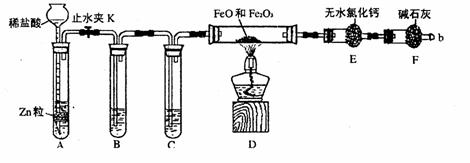
(1)实验前如何检查装置A的气密性
;对A中所发生的反应,有时要向其中加入少量硫酸铜溶液,目是 。
(2)为了安全,在点燃酒精灯之前,在F装置出口b处必须
,实验开始后,在b处必须 ______。
(3)装置C中所放试剂为浓硫酸,则装置B的作用是 。
(4)干燥管E右边又连接干燥管F的目的是 。
若无干燥管F,测得Fe2O3的质量将 (填“偏大”、“偏小”或“无影响”)。
(5)若FeO和Fe2O3混合物的质量为ag,反应完全后干燥管E的质量增加了bg,则混合物中Fe2O3的质量为 g(用含字母的数学式表示)。
28.(16分)已知烯烃在一定条件下可被强氧化剂氧化成醛,例如:
RCH=CHR′
 RCHO + R′CHO
RCHO + R′CHO
从A出发有下图所示关系:

(1)A的化学式为________________,E的结构简式__________________________________;
A→C的化学反应方程式:
_______________________________________________________________________________
(2)若B的一种同分异构体跟溴水反应生成白色沉淀,且1mol该同分异物体跟溴水反应时,需消耗3mol Br2,则符合该条件的同分异物体有_______种,写出其中任意一种的结构简式:
___________________________________________;
(3)A是一种可以作为药物的有机物,将A在一定条件下氧化可以得到两种有机酸X和Y,X属于芳香族化合物,它在食品保存及染料、药物生产中均有重要作用,则X的结构简式为:
___________________________________________;
(4)由A制E还可以通过以下途径:
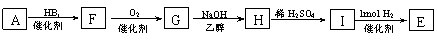
①设计步骤A→F的目的是___________________________________________________;
②写出G→H的化学反应方程式:
_____________________________________________________________________________
27.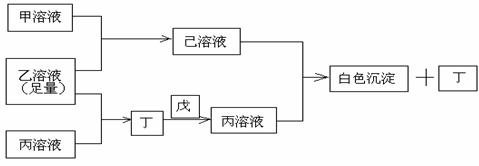 (15分)有常见A、B、C三种短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素原子最外层电子数比B元素原子最外层电子数多一个。甲、乙、丙是3种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素。常温下,甲和丙溶液的pH>7,乙溶液的pH<7;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如图:
(15分)有常见A、B、C三种短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素原子最外层电子数比B元素原子最外层电子数多一个。甲、乙、丙是3种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素。常温下,甲和丙溶液的pH>7,乙溶液的pH<7;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如图:
请回答:
(1) C元素的原子结构示意图 ,丁的结构式 ,戊的电子式 ,熔融状态下化合物乙中阴阳离子个数比为
(2) 写出有关反应的离子方程式:
①乙溶液+丙溶液→丁
②己溶液+丙溶液→丁
(3)①丙溶液中各离子浓度从大到小的顺序
②相同温度下,物质的量浓度相等的甲溶液和丙溶液pH较大的是 (填溶质的化学式)
③某温度下,纯水电离出的H+浓度为1.0×10-6mol/L,则此时水的离子积常数为 ,该温度下0.1mol/L的乙溶液中由水电离出的C(H+)=
26.(14分)甲、乙、丙、丁分别代表中学化学中常见的物质。根据要求回答下列问题。
(1)甲的化学式为RClx。
①若甲为某短周期金属元素的氯化物,甲中含有的金属元素的原子半径在同周期金属元素中最小,其阳离子与氖原子有相同的电子层结构。则甲中含有的金属元素是_____________;
②若甲为某金属元素的棕色氯化物,将该氯化物水溶液加热蒸干并灼烧,得到的氧化物为棕色粉末,则甲的化学式为_____________,甲中含有的金属元素在周期表中的位置为______________;
③将上述两种金属中活泼性强的金属与另一种金属的最高价氧化物混合,引燃后可发生剧烈反应,其化学方程式为 ,
该反应的实验操作是_________________________________________________。
(2)若甲、乙、丙、丁为单质或化合物,均含有某短周期中的同一种元素,常温下甲为气体,将甲通入常温下的KOH溶液中得到乙和丙,丙的水溶液具有强氧化性。
①电解乙溶液得到甲,该反应的化学方程式为__________________________;
②在一定条件下1mol甲与2molKOH在溶液中反应得到乙和丁,n(乙): n(丁)=5:1,该反应的离子方程式为_____________ _______________。
13.反应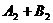
 2AB在不同温度和压强改变条件下,产物AB的生成情况,如图:a为500℃,b为300℃时情况,c为300℃时从时间
2AB在不同温度和压强改变条件下,产物AB的生成情况,如图:a为500℃,b为300℃时情况,c为300℃时从时间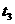 开始向容器中加压的情况,则下列叙述正确的是( )
开始向容器中加压的情况,则下列叙述正确的是( )
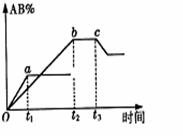
A. 、
、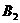 、AB均为气体,正反应放热
、AB均为气体,正反应放热
B.AB为气体, 、
、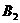 中最少有一种为非气体,正反应放热
中最少有一种为非气体,正反应放热
C.AB为气体, 、
、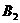 中最少有一种为非气体,正反应吸热
中最少有一种为非气体,正反应吸热
D.AB为固体, 、
、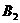 中最少有一种为非气体,正反应吸热
中最少有一种为非气体,正反应吸热
12.下列两种溶液混合后,所得溶液中各离子浓度关系不正确的是: ( )
A.0.1mol/L NaOH溶液与0.1mol/L CH3COOH溶液等体积混合
c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B.常温下,0.01mol/L NaOH溶液与pH=2的CH3COOH溶液等体积混合
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.常温下,0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液混合后使pH=7
c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
D.0.1mol/LCH3COOH溶液和0.1mol/LCH3COONa溶液等体积混合
c(CH3COO-)+c(OH-)=c(Na+)+c(H+)
11.A、B是短周期ⅦA族的两种元素,元素A的非金属性比B强,下列有关A、B的说法中正确的是:( )
A.NaA、NaB的晶体都是离子晶体
B.单质A可把B从NaB的溶液中置换出来
C.HA比HB沸点高的原因是1molHA分子中H-A键断裂时需要吸收的能量比1mol HB分子中H-B键断裂时需要吸收的能量多
D.常温下,NaA、NaB溶液的pH均大于7
10、下列各组顺序不正确的是:( )
A. 粒子半径:S2- > Cl - > F - > Na+ > Mg2+
B. 热稳定性:SiH4 < PH3 < NH3 < H2O < HF
C. 熔点: SiO2 > NaCl > 干冰 > 碘 > 臭氧
D. 还原性:HF < HCl < HBr < HI < H2S
9.锌锰干电池在放电时电池总反应方程式可以表示为:Zn+2MnO2+2NH4+==Zn2++Mn2O3 +2NH3+H2O。在此电池放电时,正极(碳棒)上发生反应的物质是( ) A.MnO2和NH4+ B.Zn2+和NH4+ C.Zn D.碳棒
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com