
题目列表(包括答案和解析)
8.某c(H+)=1×10-2mol·L-1的溶液中含有大量NO3-、SO42-,该溶液中还可能大量存在的离子是 ( )
A.NH4+ B.I- C.Ba2+ D.C6H5O-
7.下列说法正确的是 ( )
A.1LO2的质量一定比1LC12的质量小 B.1.8gH2O所含电子数为0.1NA
C.等质量的NO2和N2O4所含原子数一定相等
D.等体积、等物质的量浓度的强酸溶液中所含的H+离子数一定相等
6.下列应用与胶体性质无关的是 ( )
A.血液透析 B.盐酸除锈 C.明矾净水 D.电泳提纯
(二)实验现象记录
|
物质 |
热水(t℃) |
2.0mol/L硫酸铜溶液(t℃) |
2.0mol/L氯化铝溶液(t℃) |
饱和氯化钠溶液(t℃) |
|
(A) |
开始时有极少量气泡 |
气泡较多,比同浓度氯化铜溶液少 |
有气泡,比热水多 |
气泡比热水多,但比氯化铝溶液少 |
|
(B) |
有少量气泡 |
气泡比A多 |
气泡比A多 |
气泡比A多 |
|
(C) |
气泡比B多 |
气泡比B多 |
气泡比B多 |
气泡比B多 |
实验现象说明氢气可能是多种因素作用的结果,你认为铝和氯化铜溶液反应中产生氢气的原因可能是哪一些?(不一定填满,不够也可以自己添加)
(1)反应生成的铜和铝组成原电池,促进铝和水反应。
(2) 。
(3) 。
(4) 。
(5) 。
29.(17分)莽草酸是合成抗禽流感药物“达菲”的重要中间体,其分子式为C7H10O5。莽草酸能使溴的四氯化碳溶液褪色,等质量的莽草酸与足量的金属钠或NaHCO3反应时产生的气体体积不等。以下是以莽草酸为原料的一种合成路线(部分反应条件已省略)。
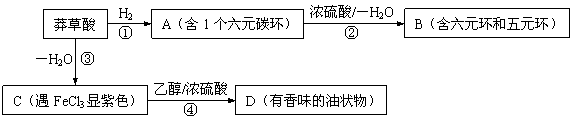
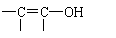
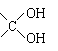 其中A分子中的羧基邻位上没有取代基,C分子中碳环上的氢被取代的一溴代物只有2种。已知有机物分子中含有
或
的结构不能稳定存在。请回答下列问题:
其中A分子中的羧基邻位上没有取代基,C分子中碳环上的氢被取代的一溴代物只有2种。已知有机物分子中含有
或
的结构不能稳定存在。请回答下列问题:
(1)写出莽草酸分子中含有的官能团名称:羧基、 、 。
(2)指出反应类型:① ,③ 。
(3)写出莽草酸的结构简式: 。
(4)写出化学反应方程式:
反应② 。
反应④ 。
(一)实验操作
1.取4根洁净的铝纯正作为A组与下列表格中的各物质反应;
2.取4根下半截缠上细铜丝的铝丝作为B组与下列表格中的各物质反应;
3.取4根前面实验中得到的附有蓬松状铜的铝丝作为C组与下列表格中的各物质反应,并与A、B组的反应作对比。
6、 最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”-全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是( )
最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”-全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是( )
A.C3F8 的摩尔质量是188
B.全氟丙烷的电子式为:
C.相同压强下,沸点:C3F8>C3Cl8
D.全氟丙烷分子中既有极性键又有非极性键
7、NA为阿伏加德罗常数,下列说法中正确的是( )
A.铁、铜和稀硫酸构成原电池,当转移了NA个电子时,产生的气体体积一定为11.2 L
B.1mol/L Mg(NO3)2溶液中含有NO3-的数目为2NA
C.室温下,28.0g乙烯和丙烯混合气体中含有的碳原子数为2NA
D.关于反应C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l);△H=-1300 kJ·mol-1,在CO2中若有4NA对共用电子对形成时,放出1300 kJ的能量
8、下列溶液中,有关离子一定能大量共存的是( )
A.能使石蕊呈蓝色的溶液中:Na+、I-、Cl-、NO3-
B.能使甲基橙呈黄色的溶液中:K+、SO32-、SO42-、ClO-
C.能使pH试纸变红色的溶液中:Mg2+、Fe3+、NO3-、[Ag(NH3)2]+
D.能跟金属铝反应生成氢气的溶液中:NH4+、Al3+、Cl-、SO42-
9、TCL集团将于2006年全面采用钛金属技术。单质钛的机械强度高,抗蚀能力强,有“未来金属”之称。工业上常用硫酸分解钛铁矿(FeTiO3)的方法来制取TiO2,再由TiO2制金属钛,主要反应有:①FeTiO3+3H2SO4 =Ti(SO4)2+ FeSO4+3H2O
②Ti(SO4)2+3H2O=H2TiO3↓+2H2SO4 ③H2TiO3 =TiO2+ H2O
④TiO2+2C+2Cl2 TiCl4+2CO
⑤TiCl4+2Mg
TiCl4+2CO
⑤TiCl4+2Mg 2MgCl2+Ti
2MgCl2+Ti
下列叙述错误的是( )
A.反应①是非氧化还原反应 B.反应②是水解反应
C.反应④中TiO2是氧化剂 D.反应⑤是置换反应
10、下列离子方程式书写正确的是( )
A.在碳酸氢铵溶液中加入等物质的量的氢氧化钡溶液
HCO3-+OH- + Ba2+ = BaCO3↓+H2O
B.4mol·L-1的NaAlO2溶液和7mol·L-1的HCl溶液等体积混合均匀
4AlO2-+ 7H+ + H2O = 3Al(OH)3↓+ Al3+
C.向Fe(OH)3中加入氢碘酸: Fe(OH)3+3H+=Fe3++3H2O
D.电解饱和MgCl2溶液: 2Cl- +2H2O = 2OH-+H2↑+Cl2↑
11、下列实验设计能够成功的是( )
|
|
实验目的 |
实验步骤及现象 |
|
A |
检验Fe(NO3)2试样是否变质 |
试样加水溶解,加盐酸酸化,加KSCN溶液,出现血红色 |
|
B |
检验某卤代烃是否是氯代烃 |
 |
|
C |
证明酸性条件H2O2氧化性比I2强 |
 |
|
D |
除去氯化钠晶体中少量硝酸钾 |
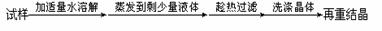 |
12、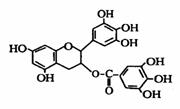 美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构如右图所示,有关EGCG的说法中不正确的是( )
美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构如右图所示,有关EGCG的说法中不正确的是( )
① EGCG能与碳酸钠溶液反应放出二氧化碳 ② EGCG遇FeCl3溶液能发生显色反应 ③ 1molEGCG最多可与含10mol氢氧化钠溶液完全作用 ④ EGCG在空气中易氧化
A.①② B.①③ C.②④ D.③④
13、常温下,0.1 mol·L-1某一元酸(HA)溶液中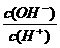 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.该溶液中由水电离出的c(OH -)=1×10-9 mol·L-1
B.浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则
c(A-)>c(HA)>c(Na+)>c(H+)>c(OH -)
C.0.1 mol·L-1HA溶液与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中
c(A-) + c(HA) = c(Na+)
D.0.1 mol·L-1HA溶液与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中
2c(H+)+ c(HA) = c(A-) + 2c(OH - )
2007年明珠学校高中毕业班质量检查Ⅱ 第Ⅱ卷
26、(15分)下图是部分短周期元素的单质熔点的变化图,根据此图,填写下列空格:
 (1)③号元素位于周期表第__________周期_______族,其单质的一种同素异形体能导电,该同素异形体的名称叫______________。
(1)③号元素位于周期表第__________周期_______族,其单质的一种同素异形体能导电,该同素异形体的名称叫______________。
(2)⑤、⑥两种元素形成的最高价氧化物对应的水化物之间相互反应的离子方程式为_____________________________________。
(3)⑦号元素的原子结构简图为_________________。
(4)②、④两元素形成的化合物其晶体有两种结构,其中一种结构与金刚石相似,该结构的晶体属___________晶体,若使其熔化,需破坏的作用力为___________________。
27、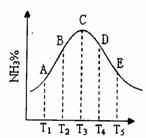 (12分)同容器中,分别充入等量的按体积比1:1混合的N2和H2,在不同温度下发生反应N2 + 3H2
(12分)同容器中,分别充入等量的按体积比1:1混合的N2和H2,在不同温度下发生反应N2 + 3H2 2NH3,并在第10s时分别测定其中NH3的体积分数并绘成如下图的曲线。
2NH3,并在第10s时分别测定其中NH3的体积分数并绘成如下图的曲线。
(1)A、B、C、D、E五点中,尚未达到化学平衡的点是__________;
(2)该可逆反应的正反应是_______(填“吸热”或“放热”)反应。
(3)由T1 向T2变化时,v正__v逆(填>、<或=,下同);由T3向T4变化时,v正__v逆。
(4)已知E点对应的纵坐标为20%,问E点混合气体的平均相对分子质量是_________,N2的转化率是_________。
28.(16分)Ⅰ在中学实验中学过的可用于分离或提纯物质的方法很多,如重结晶、过滤、盐析……,请将提纯下列各物质(括号内为杂质)最适宜方法的名称填入空格内。
(1)苯(水) 。(2)氢氧化铁胶体(氯离子) 。
(3)碘化钠固体(碘) 。(4)乙醇(食盐) 。
Ⅱ某同学在进行铝和氯化铜溶液反应实验时观察到下列现象:
(1)铝丝表面生成蓬松状的铜;
(2)有气泡逸出,在一段时间内气泡越来越快,点燃发出爆鸣声,证明是氢气。对铝和氯化铜溶液反应产生氢气的原因,该同学作出了很多猜想,并设计了下列实验进行验证:
29.(15分)某短周期元素A,其最高价氧化物对应水化物甲与其气态氢化物乙反应可生成盐丙。已知乙的密度是同温同压下H2密度的8.5倍。
请回答:
(1)乙的电子式为 。
(2)甲具有不稳定性,其发生分解的化学反应方程式为 。
实验室保存甲的方法是 。
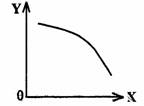 (3)在一定条件下,将乙放入固定容积的密闭容器中使其发生分解反应,已知△H>0,达到平衡状态后,改变其中一个条件X,Y随X的变化符合图中曲线的是
(3)在一定条件下,将乙放入固定容积的密闭容器中使其发生分解反应,已知△H>0,达到平衡状态后,改变其中一个条件X,Y随X的变化符合图中曲线的是
(选填字母)
a.当X表示温度时,Y表示乙的物质的量
b.当X表示压强时,Y表示乙的转化率
c.当X表示反应时间时,Y表示混合气体
|
d.当X表示乙的物质的量时,Y表示某一
生成物的物质的量
(4)现有硫酸甲的混合液20mL,其中硫酸的物质的量浓度为2mol·L-1,甲的物质的量浓度为1mol·L-1。向该混合液中加入0.96g铜粉,假设只生成一种无色气体,则所收集到的气体的体积在标准状况下为 。
(5)丙对水的电离起 作用(填“抑制”、“促进”或“不影响”),原因是(结合离子方程式简要说明)
。
26.(14分)苯氯乙酮是一种具有荷花香味的有机物,其结构简式为
(1)苯氯乙酮可能发生的化学反应类型有 (选填字母)。
a.加成反应 b.取代反应 c.消去反应 d.水解反应 e.银镜反应
 (2)同时符合①分子内有苯环但不含甲基:②氯原子与链烃基直接相连;③能发生银镜
(2)同时符合①分子内有苯环但不含甲基:②氯原子与链烃基直接相连;③能发生银镜
反应这三个要求的苯氯乙酮的同分异构体有 、
、 。

(3)已知:
苯氯乙酮的一种同分异构体M,可发生银镜反应,能用于合成杀菌剂
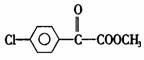
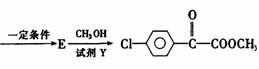 转化关系如下:
转化关系如下:

请回答:
①M的结构简式为 ,D中含氧官能团名称为 。
②A→B的化学反应方程式为 。
③C与NaOH醇溶液反应,所得产物的分子式为C8H5C1,则该产物的结构简式
为 。
 27.(16分)A、B、C三种物质的转化关系如图所示(部分产物已略去)。A是常见的金属单质,通常状况下Y单质是气体,A在Y中燃烧生成棕黄色烟,反应①、②均在水溶液中进行。
27.(16分)A、B、C三种物质的转化关系如图所示(部分产物已略去)。A是常见的金属单质,通常状况下Y单质是气体,A在Y中燃烧生成棕黄色烟,反应①、②均在水溶液中进行。
请回答:
(1)实验室可用X的浓溶液制取Y,反应的化学方程式为 ;
若反应中转移0.05mol电子,则生成Y的体积在标准状况下为 ,被氧化的X的物质的量为 。
(2)向B溶液中滴加NaOH溶液并在空气中放置一段时间,此过程中的实验现象为 ,其中涉及到的氧化还原反应方程式
为 。
(3)A与过量的X溶液反应生成B的同时还有某种气体产生,为了减缓反应速率而不影响该气体的总量,可向X溶液中加入适量的 (选填字母)
a.CH3COONa(固) b. CuSO4(固) c.KNO3溶液 d.水 e.Na2SO4溶液
(4)C溶液与草酸(H2C2O4)反应,得到澄清溶液,同时生成一种能使石灰水变浑浊的
气体,此反应的离子方程为 。
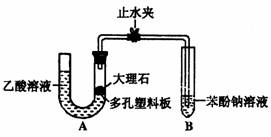 28.(15分)某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验。
28.(15分)某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验。
Ⅰ.探究乙酸、碳酸和苯酚的酸性强弱关系
该校学生设计了如下实验装置(夹持仪器已略去)。
(1)实验前如何检查装置A的气密性?
;大理石与乙酸溶液反应的化学方
程式为 。
(2)装置A中反应产生的气体通入苯酚钠溶液中,实验现象为
,反应的离子方程式为 。
(3)有学生认为(2)中的实验现象不足以证明碳酸的酸性比苯酚强,理由是
,改进该装置的方法是 。
Ⅱ.证明乙酸为弱酸。
(4)现有pH=3的乙酸溶液、蒸馏水、石蕊试液及pH试纸,用最简便的实验方法证明乙酸为弱酸:
。
13.下表中的实验操作能达到实验目的是 ( )
|
选项 |
实验操作 |
实验目的 |
|
A |
向沸腾的NaOH溶液中滴加FeC13饱和溶液 |
制备Fe(OH)3胶体 |
|
B |
通入灼热的CuO粉后收集气体 |
除去N2中混有的少量O2 |
|
C |
混合A12(SO4)3溶液和NaA1O2溶液 |
制备A1(OH)3沉淀 |
|
D |
C2H5Br和NaOH溶液混合后充分震荡再加入AgNO3检验C2H5的Br元素。 |
检验C2H5Br中的Br元素 |
2007年明珠学校高中毕业班质量检查Ⅳ
 第Ⅱ卷
第Ⅱ卷
12.下列各组数据中,前者一定比后者大的是 ( )
A.常温下pH相同的KOH溶液和K2CO3溶液中由水电离出的c(OH-)
B.浓度均为0.1mol·L-1的(NH4)2SO4溶液和(NH4)2CO3溶液中的c(NH4+)
C.0.1mol·L-1的Na2CO3溶液中c(HCO3-)和c(OH-)
D.中和pH与体积均相同的NaOH溶液和氨水,所消耗H2SO4的物质的量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com