
题目列表(包括答案和解析)
14.答案:D
解析:由信息知: 镁粉与溴水的反应机理是镁在水的催化作用下与溴发生反应。
14.某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:
①将镁粉投入冷水中,未见任何现象;
②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪去;
③将镁粉放入液溴中,未观察到任何明显现象;
④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。
则下列关于镁与溴水的反应机理的论述中正确的是
A.镁粉只直接与溴水中的溴反应
B.镁粉只与溴水中的酸反应
C.产生极少量的气泡是由于镁粉与水反应得到
D.镁粉在水的催化下与溴发生反应
13.答案:B
解析:氢氧燃料电池是一种具有应用前景的绿色电源,其中通氢气的一极为负极,发生氧化反应:2H2+4OH-→4H2O+4e-;通氧气的一极为正极,发生还原反应:O2+2H2O+4e-→4OH-;总反应方程式为2H2+O2=2H2O。故A、C、D正确,B错误。
13.燃料电池是目前电池研究的热点之一。现有某课外小组自制的氢氧燃料电池,如右图所示,a、b均为惰性电极,电解液为KOH溶液。下列叙述不正确的是
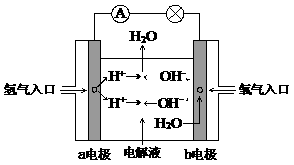
A.a极是负极,该电极上发生氧化反应
B.b极反应是O2+4OH-→2H2O+4e-
C.总反应方程式为2H2+O2=2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
12.答案:B
解析:①中Cl2与水反应生成HCl和HClO,电离出自由移动的离子,溶液中可以导电,但单质Cl2既不是电解质也不是非电解质,而电解质是化合物。故该结论不正确;②中镁条在CO2中能燃烧生成了C和MgO,故还原性:Mg>C结论正确;③中HCO3-电离出的H+与[Al(OH)4]-结合产生Al(OH)3白色沉淀,说明酸性:HCO3->Al(OH)3,故该结论正确;④中说明白磷分子比氮气分子活泼,但不能说明非金属性P比N强,恰相反,根据元素周期律,非金属性:N>P,故该结论不正确;⑤为NH4+的检验方法,该结论正确。
12.从下列事实所列出的相应结论正确的是
|
|
实 验
事 实 |
结 论 |
|
① |
Cl2的水溶液可以导电 |
Cl2是电解质 |
|
② |
将燃烧的镁条放入CO2中能继续燃烧 |
还原性:Mg>C |
|
③ |
NaHCO3溶液与Na[Al(OH)4]溶液混合产生白色沉淀 |
酸性:HCO3->Al(OH)3 |
|
④ |
常温下白磷可自燃而氮气须在放电时才与氧气反应 |
非金属性:P>N |
|
⑤ |
某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 |
该溶液一定有NH4+ |
A.③④⑤ B.②③⑤ C.①②③ D.全部
11.答案:C
解析:湿法制备和干法制备均是+3价铁变为+6价铁,每生成1 mol Na2FeO4均转移3 mol电子,K2FeO4中铁显+6价,具有强氧化性,还原产物为+3价铁化合物,能除去水体中的H2S、NH3等,生成的Fe(OH)3胶体还能吸附水中的悬浮杂质,净水。故A、B、D说法正确,C说法错误。
11.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色处理剂。工业是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4)。
湿法制备的主要反应方程为:
2Fe(OH)3+3ClO-+4OH-===2FeO42-+3Cl-+5H2O
干法制备的主要反应为:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列有关说法不正确的是
A.高铁酸钾中铁显+6价
B.湿法中每生成1 mol Na2FeO4转移3 mol电子
C.干法中每生成1 mol Na2FeO4转移4 mol电子
D.K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质
10.答案:B
解析:由信息知,该有机物为丙氨酸:CH 3CH(NH2)COOH,分子式为C3H7O2N,能发生取代反应和酯化反应,故B、C错误。
10.
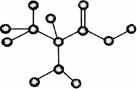 右图是某只含有C、H、O、N的有机物简易球棍模型。下列关于该有机物的说法错误的是
右图是某只含有C、H、O、N的有机物简易球棍模型。下列关于该有机物的说法错误的是
A.该有机物的分子式为C3H7O2N
B.该有机物名称为甘氨酸
C.该有机物能发生取代反应
D.该有机物能发生酯化反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com