
题目列表(包括答案和解析)
5.下列实验中,温度计的水银球不插入液面下的是( )
A.制硝基苯 B.乙醇制乙烯
C.从煤焦油中得到二甲苯 D.石油分镏收集汽油
4.下列物质有固定沸点的是( )
A.汽油 B.萘 C.石蜡 D.煤
3.裂解气的主要成分是( )
A.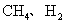 B.
B. 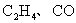
C. 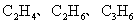 D.
D. 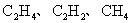
2.石油的主要成分是( )
A.烷烃、环烷烃与芳香烃 B.烷烃和烯烃
C.烷烃、芳香烃和烯烃 D.烷烃和环烷烃
1.下列变化属于化学变化的是( )
A.分镏 B.干镏 C.蒸馏 D.萃取
1.(B)(1)c; e; b。 (2)a; b。 (3)蒸发; 过滤。
2(1)用导管将A的上口和B相连(或将A换成恒压滴液漏斗);在G和H之间增加干燥装置。 (2)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O; 2S+Cl2
Mn2++Cl2↑+2H2O; 2S+Cl2 S2Cl2。
S2Cl2。
(3)饱和食盐水(或水)、浓硫酸。
(4)分液漏斗、蒸馏烧瓶;导气、冷凝。
(5)产率降低(或S2Cl2分解);有固体产生。(或其他正确描述)
(6)SCl2、Cl2、S(任写其中两种即可);控制浓盐酸的滴速不要过快。
3
 (1)MnO2 + 4H+ + 2Cl-
(1)MnO2 + 4H+ + 2Cl- Mn2+ + Cl2↑ + 2H2O(2)平衡压强 浓硫酸 使SiCl4 冷凝(3)Al、P、Cl(4)①否;KMnO4溶液自身可作指示剂;②4.480%
Mn2+ + Cl2↑ + 2H2O(2)平衡压强 浓硫酸 使SiCl4 冷凝(3)Al、P、Cl(4)①否;KMnO4溶液自身可作指示剂;②4.480%
4 (1)MnO2+2FeSO4+2H2SO4=MnSO4+Fe2(SO4)3+2H2O。
(2)Fe(OH)3、Al(OH)3。 (3)Cu2+、Zn2+。
(4)MnO2+H2O+e-=MnO(OH)+OH-(或2MnO2+H2O+2e-=Mn2O3+2OH-)
(5)锌、二氧化锰。
5(1)关闭活塞K,将末端导管插入试管A的水中,用酒精灯微热硬质试管,若末端导管有连续均匀的气泡冒出,撤去酒精灯冷却一段时间,在导管内形成一段水柱,并且一段时间不回落,则证明装置的气密性良好。
(2)反应过程中末端导管必须始终插入试管A的水中,目的是:防止空气中的氧气通过末端导管进入实验装置,氧化单质钙,生成氧化钙,引入杂质。
(3)反应结束后,先将末端导管从试管A中拔出,再熄灭酒精灯。
(4)x=2.8;因为钙的总量不变,若通入的N2中混有少量O2,所得产物中会混有氧化钙,因为氮的相对原子质量小于样的相对原子质量,结果m2偏大,n(N)会偏大,所以x值会减小。
6(1)B (2)防止NH4HCO3分解(或减少Fe2+的水解)
(3)降低K2SO4 的溶解度,有利于K2SO4 析出。
(4)2SO42- -2e- 2S2O82-
2S2O82-
6.(8分)以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸钠和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:
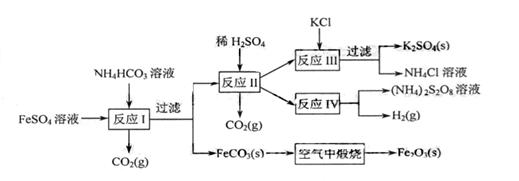
(1)反应I前需在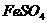 溶液中加入 (填字母),以除去溶液中的
溶液中加入 (填字母),以除去溶液中的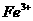 。
。
A.锌粉 B.铁屑 C.KI溶液 D.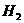
(2)反应Ⅰ需控制反应温度低于35℃,其目的是 。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是 。
(4)反应Ⅳ常被用于电解生产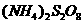 (过二硫酸铵)。电解时均用惰性电极,阳极发生地电极反应可表示为
。
(过二硫酸铵)。电解时均用惰性电极,阳极发生地电极反应可表示为
。
化学实验综合题答案
5.(12分) 某试验小组利用如下装置(部分固定装置略)制备氧化钙(Ca3N2),并探究其实验式。
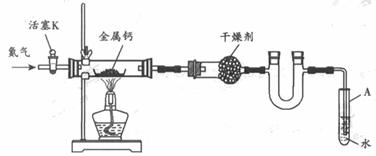
(1)按图连接好实验装置。检查装置的气密性,方法是 。
(2)反应过程中末端导管必须插入试管A的水中,目的是 。
(3)制备氮化钙的操作步骤是:①打开活塞K并通入N2;②点燃酒精灯,进行反应;③反应结束后, ;④拆除装置,取出产物。
(4)数据记录如下:
|
空瓷舟质量m0/g |
瓷舟与钙的质量m1/g |
瓷舟与产物的质量m2/g |
|
14.80 |
15.08 |
15.15 |
①计算得到实验式CaxN2,其中x= .
②若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据: 。
4.二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
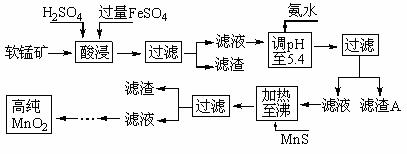
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
CuS |
ZnS |
MnS |
FeS |
|
pH |
5.2 |
3.2 |
9.7 |
10.4 |
6.7 |
8.0 |
≥-0.42 |
≥2.5 |
≥7 |
≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为_________________________。
(2)滤渣A的主要成分是_____________________________。
(3)加入MnS的目的是除去______________________杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为__________________________________。
(5)从废旧碱性锌锰电池中可以回收利用的物质有____________________________(写两种)。
3.(09浙江卷28)(15分)单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500°C),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
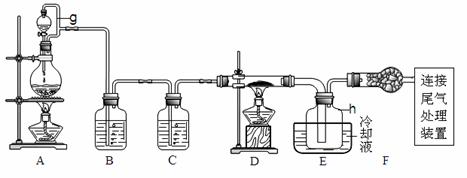
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
|
物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
|
沸点/℃ |
57.7 |
12.8 |
- |
315 |
- |
|
熔点/℃ |
-70.0 |
-107.2 |
- |
- |
- |
|
升华温度/℃ |
- |
- |
180 |
300 |
162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式 。
(2)装置A中g管的作用是 ;装置C中的试剂是 ;装置E中的h瓶需要冷却理由是 。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是 (填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,是铁元素还原成Fe2+ ,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
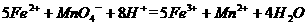
①滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
②某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml,试样溶液,用1.000×10-2mol· L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com