
题目列表(包括答案和解析)
例1:在K2Cr2O7+14HCl(浓)==2KCl+2CrCl3+3Cl2↑+7H2O反应中( )是氧化剂 ,( )是还原剂,( )元素被氧化,( )元素被还原,( )是氧化产物,( )是还原产物,电子转移总数为( )。
例2:已知AgF+Cl2+H2O→AgCl+AgClO3+HF+O2(未配平)若AgClO3系数为a,氧气系数为b,则AgCl的系数为 .
例3:当胆矾溶液渗入地下,遇黄铁矿(FeS2)时,可生成辉铜矿(Cu2S),同时还生成FeSO4和H2SO4。请配平反应方程式,并指明黄铁矿是氧化剂还是还原剂?
例4: 已知某物质的XO(OH)2+与Na2SO3反应时,XO(OH)2+作氧化剂,Na2SO3被氧化为Na2SO4。现有0.1mol XO(OH)2+需要100mL 2.5mol/L Na2SO3溶液才能把该物质还原。试问XO(OH)2+还原后X的最终价态是多少?
例5: 在含有n mol FeBr2的溶液中,通入的Cl2的物质的量为x mol。
(1)当x≤0.5n mol时,这一反应的化学方程式是 。
(2)当x≥31.5n mol时,这一反应的化学方程式是 。
(3)当x=n mol时,这一反应的化学方程式是 。
4.氧化还原方程式的配平
配平步骤:“一标、二找、三定、四配、五查”。
配平技法:要注意以下方法的适用范围。
①奇数配偶法:如S+C+KNO3--CO2+N2+K2S。
②逆向配平法:适用于歧化反应。如: S+KOH(热、浓) = K2S+K2SO3+H2O
③零价法:适宜于还原剂中两种元素价态难以确定但均属于升高的氧化还原反应。
例如:Fe3P+HNO3--Fe(NO3)3+NO+H3PO4+H2O(把Fe、P皆看成零价)
④1·n法(待定系数法)
如:KI+KIO3+H2S--I2+K2SO4+H2O(设KIO3的化学计量数为1,KI为n)
|
|
|
|
如:KMnO4+H2SO4+H2C2O4--CO2+MnSO4+K2SO4+H2O
3.氧化还原反应的一般规律
(1)得失电子守恒规律
(2)价态与表现性质规律:
(3)性质强弱规律:氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
如:2FeCl3+Cu====2FeCl2+CuCl2,氧化性:Fe3+>Cu2+,还原性:Cu>Fe2+。
(4)反应先后规律:如:把Cl2通入FeBr2溶液中,由于还原性Fe2+>Br-,当通入有限量Cl2时,根据先后规律,Cl2首先将Fe2+氧化;但Cl2足量时,方可把Fe2+、Br-一并氧化。离子方程式可分别表示为: , 。
(5)价态归中规律:
如:KClO3 + 6HCl = KCl + 3Cl2↑+ 3H2O 不是KClO3 + 6HCl = KCl + 3Cl2↑+ 3H2O
2.氧化还原反应实质的表示方法
(1)双线桥法(常用于分析氧化还原反应)注意箭头的指向不代表电子转移的方向!
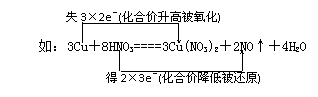
(2)单线桥法(常用于表示电子转移的实际情况)注意箭头的指向!
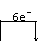
如:3Cu+8HNO3====3Cu(NO3)2+2NO↑+4H2O
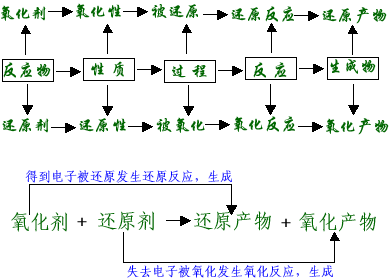
1.氧化还原反应的基本概念及其关系
11.有A、B、C、D、E、F、G 7瓶不同物质的溶液,它们各是:Na2C03、Na2SO4、KCI、AgN03、MgCl2、Ca(N03)2和Ba(OH)2溶液中的一种。为了鉴别,各取少量溶液进行两两混合,实验结果如表所示。表中“↓”表示生成沉淀或微溶化台物,“-”表示观察不到明显变化。试回答下面问题:
|
|
A |
B |
C |
D |
E |
F |
G |
|
A |
- |
- |
- |
- |
- |
- |
↓ |
|
B |
- |
- |
- |
- |
↓ |
↓ |
↓ |
|
C |
- |
- |
- |
↓ |
- |
↓ |
↓ |
|
D |
- |
- |
↓ |
- |
↓ |
↓ |
↓ |
|
E |
- |
↓ |
- |
↓ |
- |
↓ |
- |
|
F |
- |
↓ |
↓ |
↓ |
↓ |
- |
↓ |
|
G |
↓ |
↓ |
↓ |
↓ |
- |
↓ |
- |
(1)A的化学式是_______,G的化学式是_______,判断的理由是________________________。
(2)写出其余几种物质的化学式。B:______,C:______,D:______,E:______,F:______。
10.A是一种无色透明的晶体,进行如下实验:
①取少量A晶体做焰色反应实验,透过蓝色钴玻璃观察,火焰呈紫色。②取少量A晶体溶于水可以得到无色的溶液,该溶液使石蕊变红。③取少量A的溶液加过量氨水,有白色沉淀B生成。④过滤除去③中的B后,在滤液中滴加氯化钡溶液。有白色沉淀C生成,C不溶于稀硝酸。⑤取少量B滴加氢氧化钠溶液,得无色溶液D。⑥取少量B滴加盐酸,得无色溶液E。⑦将47.4g A晶体在120℃下加热脱水。剩余物的质量为25.8g。
根据上述实验现象和结果确定A、B、C、D、E,写出它们的化学式。
A________,B________,C________,D________,E________。
9.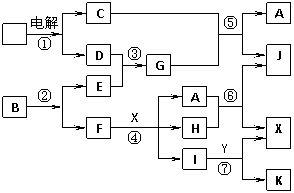 (04·苏) 下图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀。反应⑤是工业制X的主要反应之一。
(04·苏) 下图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀。反应⑤是工业制X的主要反应之一。
请按要求填空:(1)写出下列物质的化学式:A:________,E:________F:________,Y:________。
(2)反应⑤的化学方程式为:________________________________________。
(3)1 mol B通过反应②得到1 mol F,B中F的质量分数为72%,则B的化学式为:__________。
8.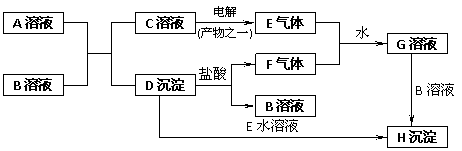 如图所示,是中学化学中常见的物质问化学反应关系,其中A的焰色呈黄色,E、F为有刺激性气味的气体,G为强酸性溶液,H为既难溶于水。又难溶于稀硝酸的白色固体。
如图所示,是中学化学中常见的物质问化学反应关系,其中A的焰色呈黄色,E、F为有刺激性气味的气体,G为强酸性溶液,H为既难溶于水。又难溶于稀硝酸的白色固体。
试回答:
(1)写出化学式:A ________ ,B________。
(2)写出下列反应的离子方程式:
①C→E________________________________。
②D→F________________________________。
③E+F+H2O→G________________________________。
7.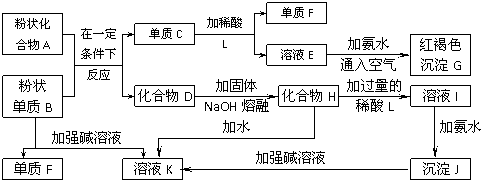 某些金属氧化物跟烧碱反应可生成盐。根据图所示关系,回答下列问题:
某些金属氧化物跟烧碱反应可生成盐。根据图所示关系,回答下列问题:
(1)单质F是________。
(2)写出由E生成G的离子反应方程式(或化学方程式)________________________________。
(3)溶液I中所含金属离子是________。
(4)由C→E+F若改用浓酸。则不能选用的浓酸是(写分子式)________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com