
题目列表(包括答案和解析)
3、下列说法中,正确的是( )
A.同周期元素的原子半径ⅦA族的为最大 B.在周期表中零族元素的单质全部是气体
C.ⅠA、ⅡA族元素的原子,其半径越大越容易失去电子
D.所有主族元素的原子形成单原子离子时的最高价数都和它的族数相等
2、核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪组原子均可产生NMR现象( )
A.18O 31P 119Sn B.27Al 19F 12C
C.元素周期表中ⅤA族所有元素的元素
D.元素周期表中第1周期所有元素的原子
1、有人认为在元素周期表中,位于ⅠA族的氢元素,也可以放在ⅦA族,下列物质能支持这种观点的是( )
A.HF B.H3O+ C.NaH D.H202
[例1] IUPAC(国际纯粹与应用化学联合会)推荐原子序数为110的元素的符号为Ds,以纪念该元素的发现地(Darmstadt,德国)。下列关于Ds的说法不正确的是( )
A .Ds原子的电子层数为7 B.Ds是超铀元素
C.Ds原子的质量数为110 D.Ds是金属元素
[例2] 已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A.原子半径A>B>D >C B.原子序数d>c>b>a
C.离子半径C>D>B>A D.单质的还原性A>B>D >C
[例3] 1919年,Lzngmuir提出等电子原理:原子数相同、电子总数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。
(1) 根据上述原理,仅由第二周期元素组成的共价分子中,互称为等电子体的是:
___________和___________;___________和___________。
(2) 此后,等电子原理又有所发展。例如,由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO2-互为等电子体的分子有:
_______________、_________________。
 [例4] 不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如下图所示。试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。1至19号元素气态原子失去最外层一个电子所需能量。
[例4] 不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如下图所示。试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。1至19号元素气态原子失去最外层一个电子所需能量。
(1) 同主族内不同元素的E值变化的特点是:_____________________,各主族中E值的这种变化特点体现了元素性质的_______________变化规律。
(2) 同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常现象,试预测下列关系中正确的是________________(填写编号)
① E(砷)> E(硒) ②E(砷)< E(硒) ③E(溴)> E(硒) ④E(溴)< E(硒)
(3)估计1mol气态Ca原子失去最外层一个电子所需能量E值的范围:
_____________<E<__________
(4)10号元素E值较大的原因是______________________________________________。
5、金属性和非金属性强弱的比较
(1) 根据原子结构: _________________________________________________;
(2) 根据在周期表中的位置: _________________________________________;
(3) 根据实验:______________________________________________________。
4、“位-构-性”之间的关系
结构―― 核电和数、原子序数、核外电子


 周期、族―― 位置
性质――物理性质,元素、单质、化合物、离子性质
周期、族―― 位置
性质――物理性质,元素、单质、化合物、离子性质
3、原子结构与元素周期表之间的关系的规律
(1) 电子层数=________________
(2) 最外层电子数=_______________=_____________=______________
(3) 核内质子数=______________
(4) 负价绝对值=8-____________(限ⅣA-ⅦA)
2、元素周期表
(1)结构
 第1周期:________种元素
第1周期:________种元素
 三个短周期 第2周期:________种元素
三个短周期 第2周期:________种元素
第3周期:________种元素
 周期( 7个横行)
第4周期:________种元素
周期( 7个横行)
第4周期:________种元素
三个长周期 第5周期:________种元素
第6周期:________种元素
一个不完全周期:第7周期
 __________个主族(含短、长周期元素):ⅠA
族-ⅦA族
__________个主族(含短、长周期元素):ⅠA
族-ⅦA族
__________个副族(只含长周期元素):ⅠB族-ⅦB族
族(18个纵行) _________(包括8、9、10三个纵行):Fe、Co、Ni等9种元素
_________:He、Ne、Ar等6种元素
(2)应用
① 预测元素的性质:常见的题目是给出一种不常见的主族元素(如砹、碲、铋、铅、铟、镭、铯等),或尚未发现的主族元素,推测该元素及其单质或化合物所具有的性质,解答的关键是根据该元素所在族的其它元素的性质,找出递变规律加以推测。
② 启发人们在一定区域内寻找物质(农药、半导体、催化剂等)。
1、元素周期律
___________________________________叫做元素周期律,
其实质是____________________________________________________。
18、一定条件下, 和
和 很容易发生反应生成
很容易发生反应生成 和
和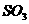 (气),该反应为不可逆反应。现将
(气),该反应为不可逆反应。现将 和
和 的混合气体通入容积为100
的混合气体通入容积为100 的密闭容器中,充满后用带有导管的塞子密封,再向其中通入
的密闭容器中,充满后用带有导管的塞子密封,再向其中通入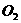 ,使之反应(忽略
,使之反应(忽略 和
和 的转化)。
的转化)。
⑴欲保持容器中压强不变,则通入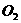 的体积(
的体积( )大小范围应为__________
)大小范围应为__________
⑵若向容器中通入40 氧气后才开始出现红棕色,且不再褪色,则原混合气体中
氧气后才开始出现红棕色,且不再褪色,则原混合气体中 的体积为______
的体积为______

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com