
题目列表(包括答案和解析)
9.下列各分子中,所有原子都满足最外层为8电子结构的是 ( )
A.H2O B.BF3 C.CCl4 D.PCl5
8.最近科学家成功地制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构,下列对该晶体叙述错误的是
( )
A.该物质的化学式为CO4
B.晶体的熔、沸点高,硬度大
C.晶体中C原子数与C-O化学键之比为1:4
D.晶体的空间最小环共有12个原子构成
7.2009年美国《科学》杂志报道:在40GPa高压下,用激光器加热到1800K,科学家成功地合成出CO2原子晶体。下列有关这种CO2晶体推断最不可能的是 ( )
A.晶体中每摩碳原子与4mol氧原子形成共价键
B.容易液化,可用作制冷材料
C.硬度很大,可用作耐磨材料
D.具有很高的熔点、沸点,还具有很大的硬度
6.下列叙述正确的是 ( )
A.微粒间以分子间作用力结合的晶体,其熔点不会很高
B.正四面体型的分子中,键与键之间的夹角一定为109028’
C.离子晶体中含有离子键,不可能含有共价键
D.金属阳离子只能与阴离子构成晶体
5.下列关于化学键的叙述,正确的是 ( )
A.离子化合物可以含共价键 B.共价化合物可能含离子键
C.离子化合物中只含离子键 D.分子晶体一定含有共价键
4.下列电子式中正确的是 ( )
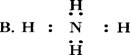
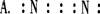

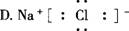
3.在下列有关晶体的叙述中错误的是 ( )
A.离子晶体中,一定存在离子键 B.原子晶体中,只存在共价键
C.金属晶体的熔沸点均很高 D.稀有气体的原子能形成分子晶体
2.13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,Kurt W uthrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N叙述正确的是 ( )
A.13C与15N有相同的中子数 B.13C与C60互为同素异形体
C.15N与14N互为同位素 D.15N的核外电子数与中子数相同
1.下列四组物质中,两种分子不具有相同核外电子总数的是 ( )
A.H2O2 和CH3OH B.HNO2 和HClO
C.H2O和CH4 D.H2S 和F2
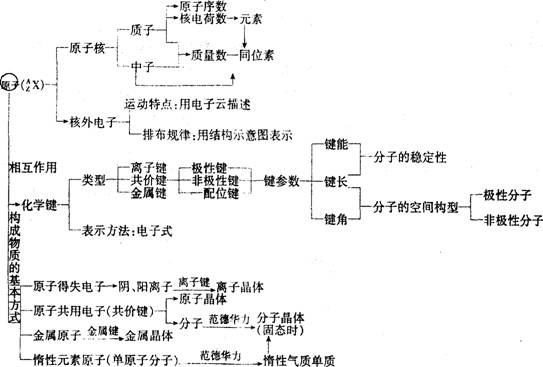
4、了解几种晶体类型(离子晶体、原子晶体、分子晶体、金属晶体)及其性质。
学习重难点:原子的组成及几个量之间的关系;离子键和共价键的含义及应用。
学习方法:该部分题目多以选择题、填空题为主,处理该部分题目时应注意概念的内涵和外延,注意选项间的比较,同时要注意以客观事例来验证理论描述。解决原子结构题目时,应注意几个量之间的数量关系。解决化学键与晶体结构的问题时,应注意化学键、分子间作用力与晶体结构、性质之间的关系,进行分析比较,最后要注意看准顺序要求。
基础知识
典型例题
例1 我国的“神舟五号”载人飞船已发射成功,“嫦娥”探月工程也正式启动。据科学家预测,月球的土壤吸附着数百万吨的3 He,每百吨核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以4 He的形式存在。下列说法正确的是 ( )
A.4 He原子核内含有4个质子 B.3 He和4 He互为同位素
C.3 He原子核内含有3个中子
D.4 He的最外层电子数为2,所以4 He具有较强的金属性
例2 下列各组物质中,互为同位素的是 ( )
A.重氢、超重氢 B.氧、臭氧 C.红磷、白磷 D.乙酸、丙酸
例3 有关晶体的下列说法中正确的是 ( )
A.晶体中分子间作用力越大,分子越稳定 B.原子晶体中共价键越强,熔点越高
C.冰融化时水分子中共价键发生断裂 D.氯化钠熔化时离子键未被破坏
例4 A、B、C、D、E分别代表5种微粒,每种微粒中都含有18个电子。其中A和C都是由单原子形成的阴离子,B、D和E都是分子;又知在水溶液中A跟B反应可生成C和D;E具有强氧化性。请回答:
(1)用化学符号表示上述5种微粒:
A ,B ,C ,D ,E 。
(2)在水溶液中A跟B反应的离子方程式是 。
例5 短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物。请回答:
(1)X元素的名称是 ;Y元素的名称是 ;Z元素的名称是 。
(2)XZ3化合物的化学式是 ,电子式是 。
(3)分别写出X、Y的含氧酸的化学式 、 。
基础训练
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com