
题目列表(包括答案和解析)
7. [探究一](1) 2 (2分) (2)②③ (2分) (3)A (2分)
[探究二]当0<x≤1/3;V=10-10x (2分) 当1>x>1/3;V=5+5x (2分)
7. 丁烷在一定条件下可以按两种方式裂解:C4H10→C2H6+C2H4;C4H10→CH4+C3H6,
某石油公司实验室对丁烷进行裂解后的裂解气进行研究。
[探究一]裂解气的系列问题
(1) 若将1mol丁烷进行完全裂解,则最终所得混合气的物质的量为 mol。
(2) 若丁烷部分裂解,则反应后混合气体平均相对分子质量可能是 (填编号)
①28.5 ②42 ③51 ④60
(3) 将1molCH4和适量的氧气在密闭容器中点燃,充分反应后,甲烷和氧气均无剩余,
且产物均为气体(101kPa,120℃),其总质量为72g,
下列有关叙述不正确的是( )
A.若将产物通过碱石灰,则可全被吸收,若通过浓硫酸,则不能被完全吸收
B.产物的平均摩尔质量为24g/mol
C.若将产物通过浓硫酸充分吸收后恢复至(101kPa,120℃),则压强变为吸收前的1/3
D.反应中消耗的氧气为56g
[探究二]测量裂解气与H2加成反应后气体总体积与氢气的体积分数关系
(4)另取丁烷完全裂解后的气体与H2的混合气体10L,已知其中H2的体积分数为x,在一定条件下使其充分反应,反应后气体的体积为V L。请列出V与x的函数关系式。
(无需解答过程)
6. Ⅰ⑴不完全,(1分);CO,(1分);CO2+C高温2CO 或 CuO+C高温Cu+CO↑ (1分);
Ⅰ⑴不完全,(1分);CO,(1分);CO2+C高温2CO 或 CuO+C高温Cu+CO↑ (1分);
⑵ 7.4g,(1分); 0.025 mol(1分)
Ⅱ、⑴ 解:依题意,m g X中:n(Cu)∶n(Fe)=1∶1
2n(Cu2+) +3n(Fe3+) =6.05mol·L-1×0.2L×2-1 mol·L-1×2.12L
故:n (Cu) = n (Fe) = 0.06mol
 又,n (S) = 0.6mol·L-1×0.1L×2 = 0.12mol
又,n (S) = 0.6mol·L-1×0.1L×2 = 0.12mol
因此,m g = m(Cu) + m(Fe) + m(S)
= 0.06mol×64g·mol-1+0.06mol×56g·mol-1+0.12mol×32g·mol-1= 11.04g
即m 的值为11.04 (3分)
⑵ 解:设X的化学式为(CuFeS2)n,则
(64+56+32×2)×n = 368 n = 2故X的化学式为Cu2Fe2S4 (3分)
6. 铜是人类最早知道的金属之一,实验室可用C、H2还原CuO制取少量的Cu,工业上主要用火法从黄铜矿中提炼Cu。
Ⅰ(6分)实验证明,C还原CuO时既可能生成Cu,也可能生成Cu2O,即使在C过量时,实验中CuO也可能部分未被还原。为了测定某次实验产物的组成,取1.2 g C跟8.0 g CuO混合加热,将反应生成的气体通过足量的澄清石灰水并集气。一段时间后停止加热,共收集到560 mL气体(已经折算成标准状况),测得沉淀的质量为2.5 g。则:
⑴ 上述实验中C (填“完全”或“不完全”)参加反应,实验中收集到的气
体是 (填写化学式),产生这种气体的化学方程式为:
。
⑵ 反应后得到的固体混合物总质量为 ,其中含氧化合物的物质的
量为 mol。
 Ⅱ. 黄铜矿的主要成分X是由Cu、Fe、S三种元素组成的复盐,其中Cu、Fe两种元素的质量比为8∶7;将m g X粉末全部溶于200 mL的浓HNO3,反应后的溶液加水稀释至 2.12 L时测得其pH为0;将稀释后的溶液分为两等份,向其中一份溶液中滴加6.05mol/L的NaOH溶液,向另一份溶液中滴加0.600mol/L Ba(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶液的体积变化如下图所示:
Ⅱ. 黄铜矿的主要成分X是由Cu、Fe、S三种元素组成的复盐,其中Cu、Fe两种元素的质量比为8∶7;将m g X粉末全部溶于200 mL的浓HNO3,反应后的溶液加水稀释至 2.12 L时测得其pH为0;将稀释后的溶液分为两等份,向其中一份溶液中滴加6.05mol/L的NaOH溶液,向另一份溶液中滴加0.600mol/L Ba(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶液的体积变化如下图所示:
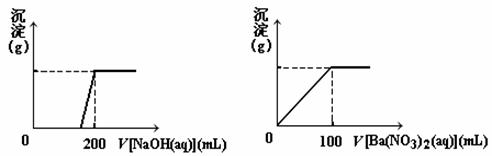
⑴ 请通过计算确定m的值;
 w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
⑵ X的摩尔质量为368 g/mol,请确定X的化学式。
5. (1)Pb3O4+8HCl(浓)→3PbCl2+Cl2↑+4H2O(1分)
(2)L(2分)
(1)Pb3O4+8HCl(浓)→3PbCl2+Cl2↑+4H2O(1分)
(2)L(2分)
(3)①根据题意:分解所得混合物中n(Pb2+)= x mol、n(Pb4+)= (1-x) mol(各1分)
根据得失电子守恒:n(O2)= x/2 mol、n(Cl2)=(1-x) mol (各1分,共2分)
y=n(O2)+n(Cl2)=x/2 mol+ (1-x) mol= (1-x/2) mol(1分)
②Pb2O3、Pb3O4 (2分) 4: 1(1分)(过程合理,答案正确即给分)。
5. 已知:Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,能氧化浓盐酸生成C12;
(1)写出Pb3O4与浓盐酸反应的化学方程式 。
(2)PbO2不稳定,随温度升高按下列顺序逐步分解:PbO2→Pb2O3→Pb3O4→PbO。若加热分解后所得到的固体全部为Pb3O4,现将a mol PbO2加热分解,则加热过程中放出O2_______L(标准状况下);
(3)现将1 mol PbO2加热分解,收集产生的O2,加热分解后所得固体中,pb2+占Pb元素的物质的量分数为x;再向加热所得固体中加入足量的浓盐酸,收集产生的C12,收集到O2和C12的物质的量之和为y mol。
试回答下列问题:
①通过计算确定y与x的函数关系式。

 ②若两步反应中O2和Cl2的物质的量之比为3:5,则剩余固体中含有的物质为
,其物质的量之比为
。
②若两步反应中O2和Cl2的物质的量之比为3:5,则剩余固体中含有的物质为
,其物质的量之比为
。
4. (1) (C6H10O5)n+nH2O→3nCH4↑+3nCO2↑ (2分)
(2)9.20 (162 kg纤维素→ 300 mol CH4 300 mol CO2 → 400 mol CH3OH → 200 mol CH3OCH3) (2分)
(3) 设反应③中消耗O2的物质的量为x,则N2的物质的量为4x
2CH4+O2→4H2+2CO CH4 + H2O → 3H2 + CO
2x x 4x 2x 1×103-2x (1×103-2x)×3 (1×103-2x)
合成二甲醚反应中CO和H2为1∶2,合成氨反应中,N2与H2体积比为1∶3,则
4x+(1×103-2x)×3-[2x+(1×103-2x)]×2=4x×3 (关系式2分)
x=1000/14 mol
NH3 :4x×2×17=9.71 kg (结果2分)
4. 二甲醚(CH3OCH3)简称CME,是一种理想的煤基清洁燃料,可由生物甲烷或天然气合成。合成二甲醚主要步骤为造气和合成。过程如下:
二甲醚(CH3OCH3)简称CME,是一种理想的煤基清洁燃料,可由生物甲烷或天然气合成。合成二甲醚主要步骤为造气和合成。过程如下:


(1)生物甲烷是由植物在一定条件下发酵(代谢产物为相等物质的量的CH4和CO2 )而制得,植物纤维素发酵制得甲烷的化学方程式为 。
(2)若162 kg纤维素含量为10%的农作物桔杆,在微生物作用下完全转化为CH4和CO2,通入适量的水蒸气合成二甲醚,理论上最多可得到 kg的二甲醚。
(3)若天然气中只含CH4,空气中只含N2和O2,且体积比为4∶1。某企业用标准状况下22.4 m3天然气及水蒸气、空气为原料生产二甲醚,同时利用N2与H2合成氨。在合成二甲醚的同时,理论上还可得到多少千克的NH3?(假设天然气完全反应后的N2全部转化为NH3,且生产过程中转化率均为100%;合成塔中水与CO不反应)
3.(1)1-2.33a%(2分)
(2)10; 200; 50(元素守恒) (各2分)
(提示:设通入的水蒸气为Xm3,则有
CH4+CO2→2H2+2CO CH4+H2O→3H2+CO
5 5 10 10 X X 3X X
2CH4 + O2→ 4H2 + 2CO
95-5-X
 2(95-5-X) 95-5-X
2(95-5-X) 95-5-X
所以有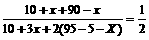 ,可以得出X=10m3,
,可以得出X=10m3,
通入的空气的体积为:5× =200 m3 ).
=200 m3 ).
(3)CO(1分);360(1分)。
3. 甲醚(CH3OCH3)是一种新型的合成“柴油”,它可由天然气(体积分数:CO2为5%,CH4为95%)合成。合成甲醚主要步骤为造气和合成。过程如下(气体体积均在同温同压下测定;氧气由空气提供,其中N2和O2的体积比为4:1;不考虑CO与水的反应;各步反应转化率均为100%):
|
|

(1)若造气得到的气体只含CO和H2,该混合气体中,碳元素的质量分数为a%,则氢元素的质量分数为 %(用含a的式子表示)。
(2)造气时每使用100m3天然气,应同时通入水蒸气________m3、空气_________m3,才能保证合成时CO与H2的体积比为1:2;合成甲醚后,有________m3的水蒸气可参加循环生产。
(3)若只用天然气和空气造气,合成后得到的蒸气成分如下表:
|
气体 |
CH3OCH3 |
H2O |
N2 |
A |
|
体积(m3) |
95 |
95 |
x |
y |
则A气体的分子式为 ; x = 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com