
题目列表(包括答案和解析)
5. (14分)(1)Fe、C、Si、Al (2)NO2、Fe(OH)3 (3)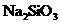 、
、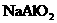
 、
、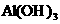 (4) C +4 HNO3(浓)===CO2 + 4NO2 +
2H2O
(4) C +4 HNO3(浓)===CO2 + 4NO2 +
2H2O
(5)2Al + 2NaOH + 2H2O ==2NaAlO2 + 3H2 或Si + 2NaOH + H2O ==Na2SiO3 + 2H2(6)SiO32- + 2H+ + H2O ==H4SiO4 或 AlO2- + H+ + H2O ==Al(OH)3
5. 合金A由4种单质组成,经过一系列反应分别进入了沉淀或气体中.



试回答:
(1)合金A由哪4种元素的单质组成?_________、________、________、_________.
(2)写出红棕色气体和红褐色沉淀的化学式 、
(3)写出溶液C、沉淀D有关组成的化学式:C_________、D_________
(4)写出红热固体与浓硝酸反应得化学方程式
(5)写出合金A中的有关组成与过量烧碱溶液反应生成无色气体E的化学反应方程式:(只写一个)______ ___________________________________________________.
(6)写出向无色溶液C加适量盐酸生成白色沉淀D有关反应的离子方程式:(只写一个)__________________________________________________________________________.
4. ⑴ Al2O3 CO(NH2)2 ⑵ N2+Al2O3+3C 3CO+2AlN
3CO+2AlN
⑶ AlN+OH-+H2O=AlO2-+NH3↑ ⑷ ④⑦
4. 下图涉及多种无机化工反应,其中R是一种新型无机材料,M是一种应用广泛的金属材料,F是人工合成的第一种有机物,且是一种常见的化学肥料,A、C、D、M均为常见元素的单质,“↑”表示该物质常温下是气体,反应G+J→F+H2O中G与J的最佳配比为2∶1,向Y溶液中通入足量的J气体时可得到一种白色胶状沉淀,将该白色胶状沉淀滤出洗净后加热分解可以得到B。

⑴ 试写出下列指定物质的化学式:B_________________,F_____________。
⑵ 反应①的化学方程式为___________________________________________。
⑶ 反应④的离子方程式为___________________________________________。
⑷ 上述反应中属于非氧化还原反应的有_____________(填写相应反应的序号)。
3. ⑴ NO Ag(NH3)2OH
 ⑵① 4Ag++2H2O
⑵① 4Ag++2H2O  4Ag↓+4H++O2↑
4Ag↓+4H++O2↑
⑦ CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-
⑶ Al4SiC4+2N2 4AlN+SiC+3C
4AlN+SiC+3C
3. 下图是一些物质间的转化关系图,图中所有物质含有的元素中只有一种不是短周期元素,所有反应物、生成物及溶液中的水以及部分反应中一些生成物未标出。C、D、E、K为单质,N为两性化合物。J是由两种元素组成的和SiC相同晶体类型的新型材料,且J和SiC具有相同的价电子数和原子数。I是由四种元素组成的强碱。反应③用于检验一种常见的有机官能团,反应⑤、⑥用于工业中生产B。
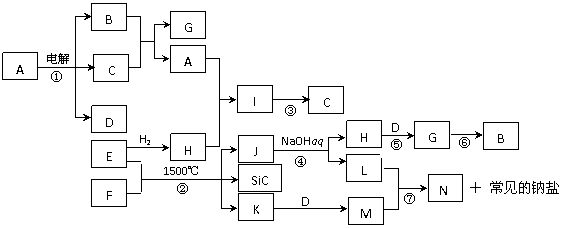
回答下列问题:
⑴ 写出下列物质的化学式:G 、I ;
⑵写出反应①、⑦的离子方程式:
① ,
 ⑦ ;
⑦ ;
⑶ J和SiC的纳米级复合粉末是新一代大规模集成电路理想的散热材料。反应②是日本科学家研究开发制备该纳米级复合粉末的最新途径。已知反应②中n(F)∶n(E)∶n(J)∶n(SiC)∶n(K)=1∶2∶4∶1∶3,写出反应②的化学方程式 。
2.⑴ 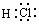 ⑵ 2Cl-+2H2O
⑵ 2Cl-+2H2O H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
⑶ Na2SO3+S=Na2S2O3 ⑷ 通过不同浓度的硫酸和同浓度的硫代硫酸钠溶液反应产生乳白色浑浊的速率不同,说明浓度对反应速率的影响
2. 下图为部分短周期元素的单质和化合物之间的转化关系(部分反应的反应物和产物未列出)。A、F、G、M为非金属单质,其中A单质常温下的状态和F、G、M不同。反应①、②、④、⑤为化工生产中的重要反应,且E、L均为重要的化工产品。反应①、③、④的类型相同,且反应③中A、H物质的量之比为1∶1。



回答下列问题:
⑴ I的电子式为 ;
⑵ 反应②的离子方程式为 ;
⑶ 反应③的化学方程式为 ;
⑷ 举例说明反应⑥的一个用途 。
1. (1)HClO4>H2SO4>H2CO3 (2分)
(2)SO3、CO、NO(2分) N2H4+4OH--4e-=N2+4H2O(2分)
(3)Cu2++2e-=Cu (2分) 2Al+Fe2O3=Al2O3+2Fe(2分)
1. 有①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩十种元素,原子序数依次增大,⑨、⑩处于第四周期,其余均为短周期元素。
有①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩十种元素,原子序数依次增大,⑨、⑩处于第四周期,其余均为短周期元素。
(1) 若②、⑦、⑧三种元素在周期表中相对位置如下:
|
② |
 |
|
|
|
|
|
⑦ |
⑧ |
②与⑦、②与⑧形成的液体化合物是常见的重要溶剂,则②、⑦、⑧三种元素最高价氧化物对应的水化物酸性由强到弱的顺序是: (用化学式表示)。
 (2)若甲、乙、丙、丁、戊均为上述八种短周期元素中的某些元索组成的单质或由其中两种元素组成的化合物,且甲、戊为无色气体,反应a为置换反应,反应b为化合反应。见右图示转化关系推测:戊可能为:
(列举合适的一例)。
(2)若甲、乙、丙、丁、戊均为上述八种短周期元素中的某些元索组成的单质或由其中两种元素组成的化合物,且甲、戊为无色气体,反应a为置换反应,反应b为化合反应。见右图示转化关系推测:戊可能为:
(列举合适的一例)。
若甲是O2、乙是N2H4,反应a是在强碱性溶液中进行的的原电池反应,则负极发生的电极反应式为: 。
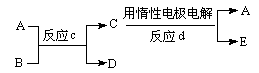 (3)若右下图中A、B、C、D、E分别是上述10种元素中的某些元素组成的单质或其中两种元素组成的化合物.已知:A是常见的金属单质,反应c为置换反应类型。若反应c是用A作电极,在B的水溶液中进行电解反应,它们有如右图示转化关系。则反应d中阴极的电极反应式为:
(3)若右下图中A、B、C、D、E分别是上述10种元素中的某些元素组成的单质或其中两种元素组成的化合物.已知:A是常见的金属单质,反应c为置换反应类型。若反应c是用A作电极,在B的水溶液中进行电解反应,它们有如右图示转化关系。则反应d中阴极的电极反应式为:
。
若反应c是在高温下进行的,且为工业上有重要应用价值的放热反应,当物质C是一种两性化合物,则反应c的化学方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com