
题目列表(包括答案和解析)
7.[江苏省2009年高考化学模拟测试](12分)
(A)HN3称为叠氮酸,常温下为无色有刺激性气味的液体。
N3-也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:
NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可
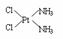
溶解铜、铂、金等不活泼金属,如溶解铜生成CuCl2-。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图,图中小黑球代表氧原子,其余大黑球为Y 、Cu 、Ba原子)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中异构体B可溶水,可用于治疗癌症。试回答下列问题:
(1)基态氮原子核外电子排布的轨道表示式为 ▲ 。
(2)元素N、S、P的第一电离能(I1)由大到小的顺序为 ▲ 。
(3)HN3属于 ▲ 晶体,与N3-互为等电子体的分子的化学式为 ▲ (写1种)。
NH2-的电子式为 ▲ ,其中心原子的杂化类型是 ▲ 。
(4)CuCl2-中的键型为 ▲ ,1mol超导氧化物A晶胞中实际占有的氧原子的物质的量为 ▲ 。
 (5)治癌药物B的结构简式为
▲
。
(5)治癌药物B的结构简式为
▲
。
答案.(A))(1)
(2)N>P>S
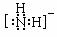
(3)分子, CO2 (N2 COS CS2,写1个即可), sp3
(4) 配位键(写共价键也可) 7mol
(5)
5、( 江苏省淮阴中学2009届高三化学仿真模拟试题(九))2005年有科学家在《Science》上发表论文,宣布发现铝的超原子结构Al13和 Al14,并在质谱仪检测到稳定的Al13-和 Al142+等。Al13、Al14的性质很像现行周期表中某些主族元素,已知当这类超原子具有40个价电子时最稳定。下列说法不正确的是[C]
A. Al13与卤素原子性质相似,能形成稳定的Al13-
B. Al14与HI反应的化学方程式为:Al14+2HI==Al14I2+H2
C. Al13超原子中Al原子间是通过离子键结合的
D. Al14与ⅡA族元素性质相似,容易失去2个电子形成稳定的Al142+
6( 江苏省淮阴中学2009届高三化学仿真模拟试题(九))目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
⑴配合物Ni(CO)4常温为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 晶体;基态Ni原子的电子排布式为 。
⑵配合物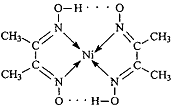 分子内的作用力有
(填编号)。
分子内的作用力有
(填编号)。
A.氢键 B.离子键 C.共价键 D.配位键
 ⑶很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH≡CH、③
⑶很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH≡CH、③ 、④HCHO等,其中碳原子采取sp2杂化的分子有
、④HCHO等,其中碳原子采取sp2杂化的分子有
(填物质序号),预测HCHO分子的立体结构为 形。
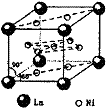
⑷氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如右图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点。该晶体的化学式 。
答案、⑴分子 1s2s22p63s23p63d84s2或[Ar]3d84s2 ⑵ACE ⑶①、③、④ 平面三角⑷LaNi5或Ni5La(每空2分)
2.[江苏省启东中学2009届高三最后一考]A(12分)决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
|
电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
|
A |
578 |
1817 |
2745 |
11578 |
|
B |
738 |
1451 |
7733 |
10540 |
A通常显________价,A的电负性_____B的电负性(填“>”、“<”或“=”)。
(2)已知:波长为300nm的紫外光的光子所具有的能量约为399 kJ/mol。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:__________________________________________________________________________
|
共价键 |
C-C |
C-N |
C-S |
|
键能/ kJ·mol-1 |
347 |
305 |
259 |

(3)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如右图所示),其中3种离子晶体的晶格能数据如下表:
|
离子晶体 |
NaCl |
KCl |
CaO |
|
晶格能/kJ·mol-1 |
786 |
715 |
3401 |
离子键的强弱可以用离子晶体的晶格能来衡量。KCl、MgO、CaO、TiN 4种离子晶体熔点从高到低的顺序是_____________________________。MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有__________________个。
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是__________________。
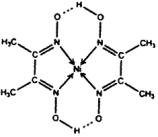 (5)某配合物的分子结构如下图所示,其分子内不含有_____________(填标号)。
(5)某配合物的分子结构如下图所示,其分子内不含有_____________(填标号)。
A. 离子键
B. 共价键
C. 金属键
D. 配位键
E.氢键
答案、(1)+3(1分);>(1分)
(2)紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子(2分)
(3)TiN>MgO>CaO>KCl(2分);12(2分) (4)CrO2(2分) (5)AC(2分)
3( 江苏省淮阴中学2009届高三化学仿真模拟试题 )四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
原子核外有两个电子层,最外层有3个未成对的电子 |
原子的M层有1对成对的p电子 |
原子核外电子排布为[Ar]3d104sx, 有+1、+2两种常见化合价 |
有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
⑴写出B原子的电子排布式 。
⑵A元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低”),其原因是___________________________________________________________________。
⑶D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点 (填“高”或“低”),其原因是_______________________________________________________。
⑷往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为________________,简要描述该配合物中化学键的成键情况__________________。
 ⑸下列分子结构图中的“
”表示上述相关元素的原子中除去最外层电子的剩余部分,
⑸下列分子结构图中的“
”表示上述相关元素的原子中除去最外层电子的剩余部分,
“ ”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
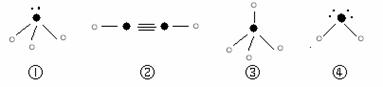
则在以上分子中,中心原子采用sp3杂化形成化学键的是 (填写序号);
在②的分子中有 个σ键和 个π键。
答案、⑴ 1s22s22p63s23p4 (1分)
⑵高,因为A的氢化物分子间存在氢键 (各1分)
⑶低,晶体类型不同 (各1分)
⑷[Cu(NH3)4]SO4(1分), 中心原子与配位体之间以配位键相结合,内界与外界之间以离子键相结合(1分)
⑸①③④(3分);3 (1分) 2(1分)
19.(12分)推断下列化合物的化学式:
⑴X、Y两元素能形成XY2型化合物,XY2中共有38个电子,若XY2是离子化合物,其化学式是_____;若XY2是共价化合物其化学式是______。
⑵第三周期内,X、Y两元素的原子序数之差为4,它们组成的XY型化合物,其化学式为______。
⑶1mol某共价化合物,含有三种短周期元素的原子各1mol,且三种元素分别属于不同的周期,其质子总数为26mol,其中一种元素的最外层有7个电子,则该物质的化学式为______。
⑷某非金属X的最低负价为-2,它的最高价氧化物对应的水化物为强酸,则这种酸的化学式是________。
⑸X元素的最高正价和负价绝对值之差为6,Y元素的化合价为+1,Y元素和X元素原子的次外电子层上都有8个电子,X和Y形成的化合物在水溶液中能电离出电子层结构相同的离子,则该化合物是_________ 。
20.(12分)1996年诺贝化学奖授予对发现C60有重大贡献的三位科学家.C60分子是形如球状的多面体(如图),该结构的建立基于以下考虑:
①C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②C60分子只含有五边形和六边形;
③多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:
据上所述,可推知C60分子有12个五边形和20个六边形,C60分子所含的双键数为30。
请回答下列问题:
(1)固体C60与金刚石相比较,熔点较高者应是____________,理由是:
_________________________________________________________。
(2)试估计C60跟F2在一定条件下,能否发生反应生成C60F60(填“可能”或“不可能”)
___________________,并简述其理由:________________________________。
(3)C70分子也已制得,它的分子结构模型可以与C60同样考虑而推知.通过计算确定C70分子中五边形和六边形的数目:C70分子中所含五边形数为____________,六边形数为_________。
18.(8分)C60、金刚石和石墨的结构模型如下图所示(石墨仅表示出其中的一层结构):
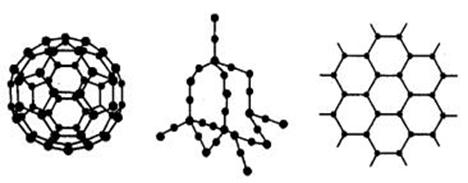 (1)C60、金刚石和石墨三者的关系互为________。
A、同分异构体 B、同素异形体
C、同系物 D、同位素
(2)固态时,C60属于________晶体(填“离子”“原子”或“分子”)
(1)C60、金刚石和石墨三者的关系互为________。
A、同分异构体 B、同素异形体
C、同系物 D、同位素
(2)固态时,C60属于________晶体(填“离子”“原子”或“分子”)
(3)硅晶体的结构跟金刚石相似,二氧化硅的结构相当于在硅晶体结构中每个硅硅单键之间插入1个氧原子。二氧化硅的空间网状结构中,硅、氧原子形成的最小环上氧原子数目是________。 (4)石墨层状结构中,平均每个正六边形占有的碳原子数是_________。
17.(8分)有关物质的熔、沸点数据如下表:
|
|
MgO |
Al2O3 |
MgCl2 |
AlCl3 |
|
熔点/℃ |
2852 |
2072 |
741 |
190(2.5×105Pa) |
|
沸点/℃ |
3600 |
2980 |
1412 |
182.7 |
请参考上述数据填空和回答问题。
(1)工业上常用电解熔融MgCl2的方法生产金属镁,不用电解熔融MgO的方法生产镁,原因是 能用电解熔融AlCl3的方法生产铝吗? (填能或不能),原因是:
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是:
。
16.(20分)已知X、Y、Z、W是元素周期表中短周期中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的阳离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。试回答:
(1)写出下列元素的元素符号和电子排布式:
X_____ __ __ Y____ _____
Z___ _ _____ W____ _____
(2)X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为________________________ ______。E分子的空间构型为_________。E在催化剂存在的条件下可用于还原汽车尾气中的______,以减少对大气的污染。
(3)仅由X、Z、W三种元素组成的某种盐是一种速效肥料,但长期施用会使土壤酸化,有关的离子反应方程式为___________ __________________ __________
(4)这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序)为 ,该化合物的水溶液与足量NaOH溶液反应的化学方程式为 ____________ __ __
15.(12分)请完成下列各题:
(1)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有 种。
(2)第ⅢA、ⅤA族元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为 。在GaN晶体中,每个Ga原子与 个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为 。在四大晶体类型中,GaN属于 晶体。
(3)在极性分子NCl3中,N原子的化合价为-3,Cl原子的化合价为+1,请猜测NCl3水解的主要产物是 (填化学式)。
14.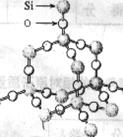 二氧化硅晶体是空间网状结构,如右图所示。关于二氧化硅晶体的下列说法中,不正确的是( )
二氧化硅晶体是空间网状结构,如右图所示。关于二氧化硅晶体的下列说法中,不正确的是( )
A.1 mol SiO2 晶体中Si-O键为2mol
B.晶体中Si、O原子个数比为1:2
C.晶体中Si、O原子最外电子层都满足8电子结构
D.晶体中最小环上的原子数为8
二卷(主观题,共72分)
13.下列物质性质的变化规律与分子间作用力有关的是( )
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.金刚石的硬度大于硅,其熔、沸点也高于硅
C.NaF、NaCl、NaBr、NaI的熔点依次降低
D.F2、Cl2、Br2、I2的熔、沸点逐渐升高
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com